在有机物分子中,若某个碳原子连接着四个不同的原子或原子团,这种碳原子称为“手性碳原子”,凡有手性碳原子的物质一定具有光学属性。如图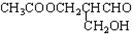 ,该有机物发生下列反应后的生成物还有光学活性的是( )
,该有机物发生下列反应后的生成物还有光学活性的是( )
| A.与乙酸发生酯化反应 | B.与NaOH 水溶液共热 |
| C.与银氨溶液作用 | D.在催化剂存在下与氢气反应 |
下列关于物质的量浓度表述正确的是
| A.0.3 mol·L-1 Na2SO4溶液中含有Na+和SO总物质的量为0.9 mol |
| B.50mL 1 mol·L-1的KCl溶液和100mL 0.5 mol·L-1MgCl2溶液中,Cl-的物质的量浓度相等 |
| C.用1 L水吸收22.4 L氨气所得氨水的浓度是1 mol·L-1 |
| D.10 ℃时0.35 mol·L-1的KCl饱和溶液100 mL,蒸发掉5 g水,再冷却到10 ℃时,它的物质的量浓度仍为0.35 mol·L-1 |
已知5KCl+KClO3+3H2SO4=3Cl2↑+3K2SO4+3H2O,下列说法不正确的是
| A.KClO3是氧化剂 |
| B.被氧化与被还原的氯元素的质量比为5:1 |
| C.H2SO4既不是氧化剂又不是还原剂 |
| D.1mol KClO3参加反应时有10mol电子转移 |
以下是对某溶液进行离子检验的方法和结论,其中正确的是
| A.先加入BaCl2溶液,再加入HNO3溶液,产生了白色沉淀,则溶液中一定含有大量的SO42- |
| B.加入足量的CaCl2溶液,产生了白色沉淀,则溶液中一定含有大量的CO32- |
| C.加入盐酸,能产生使澄清石灰水变浑浊的气体,则溶液中一定含有CO32- |
| D.先加适量的硝酸将溶液酸化,再加入AgNO3溶液,产生了白色沉淀,则溶液中一定含大量的Cl- |
下列实验设计方案中,可行的是
| A.用碱石灰除去氯气中的水 |
| B.在某试样中加入NaOH溶液加热,产生能使蓝色石蕊试纸变红的气体即证明有NH4+ |
| C.焰色反应实验中用硫酸清洗铁丝,灼烧后再沾取试样在酒精灯上灼烧观察[ |
| D.分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 |
根据世界环保联盟的要求,广谱消毒剂ClO2将逐渐取代Cl2成为生产自来水的消毒剂。工业上ClO2常用NaClO3和Na2SO3溶液混合并加H2SO4酸化后反应制得,则反应后Na2SO3转化为
| A.Na2SO4 | B.SO2 | C.S | D.Na2S |