—定质量的Al、Mg合金与适量的稀硫酸恰好完全反应,将反应后的溶液蒸干,所得固体(不含结晶水)质量比原固体增加了 7.2g,则该合金的物质的量可能为
| A.0. 06mol | B.0. 05mol | C.0.08mol | D.0.09mol |
将51.2 g Cu完全溶于适量浓硝酸中,收集到氮的氧化物(含NO、N2O4、NO2)的混合物共0.8mol,这些气体恰好能被500mL2mol/L NaOH溶液完全吸收,发生的反应为:2NO2+2NaOH===NaNO2+NaNO3+H2O、NO+NO2+2NaOH===2NaNO2+H2O
则生成的盐溶液中NaNO3的物质的量为


| A.0.2 mol | B.0.4 mol | C.0.6 mol | D.0.8 mol |
25℃时,在25mL0.1mol/L的NaOH溶液中逐滴加入0.2 mol/L CH3COOH溶液,混合溶液pH的变化曲线如图所示,下列分析结论正确的是
| A.a=12.5,且混合溶液pH=7 |
| B.对应曲线上E、F之间的任何一点,溶液中都有c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
| C.P点时,c(CH3COO-)>c(Na+)>c(H+)=c(OH-) |
| D.K点时,c(CH3COO-)+c(CH3COOH)=2c(Na+) |
恒温、恒压下,在容积可变的密闭容器中通入1molX和1molY,发生反应 X(g)+Y(g)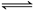 Z(g),达到平衡后生成amolZ,下列说法错误的是
Z(g),达到平衡后生成amolZ,下列说法错误的是
| A.达到平衡时-v正(Y)=-v逆(Z) |
| B.若向平衡混合物中充入氦气,平衡向左移动 |
| C.若最初向容器中通入的是3molX和3molY,达平衡后Z的物质的量分数为 |
| D.若最初向容器中通入的是3molX、2molY、1molZ,达平衡后容器中n(Z)<3amol |
设NA为阿伏加德罗常数的数值,下列说法正确的是
| A.1molC10H22分子中共价键总数为31NA |
| B.18 g2H2O中所含的电子总数为10NA |
| C.24 g NaH中阴离子所含电子总数为NA |
| D.标准状况下,11.2 LCO2和O2混合气体中含有的氧原子数为2NA |
X、Y、Z、W都是元素周期表中前20号元素,它们的原子序数依次增大。已知:
①W的阳离子和Z的阴离子具有相同的核外电子排布,且能形成组成为WZ的化合物;
②Z和Y属同族元素,它们能形成两种常见化合物;
③X和Y属同一周期元素,它们能形成两种气态化合物;
④W和X能形成组成为WX2的化合物;
⑤X和Z不在同一周期,它们能形成组成为XZ2的化合物。
下列说法不正确的是
A.XY2是以极性键结合成的非极性分子  |
| B.XY2、XZ2的化学键类型和晶体类型都相同 |
| C.WY、ZY2分子中所有原子最外层都为8电子结构 |
| D.离子半径大小顺序为Y<W<Z |