设NA为阿伏加德罗常数,下列说法正确的是( )
| A.常温常压下,Na2O2与足量H2O反应,共生成0.2 mol O2,转移电子的数目为0.4NA |
| B.在反应KIO3+6HI==KI+3I2+3H2O中,每生成3 mol I2转移的电子数为6NA |
| C.标准状况下,11.2 L的SO3所含分子数为0.5NA |
| D.室温下,8 g甲烷含有共价键数为2NA |
下列有关乙烯化学性质的说法,错误的是
| A.乙烯能使酸性高锰酸钾溶液褪色,是由于乙烯发生了氧化反应 |
| B.乙烯可在氧气中燃烧,该反应属于乙烯的氧化反应 |
| C.乙烯能使溴的四氯化碳溶液褪色,该反应属于加成反应 |
| D.将乙烯通入溴水中,反应后得到均一、透明的液体 |
关于下图所示的原电池,下列说法错误的是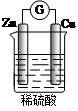
| A.Cu为正极,Zn为负极 |
| B.该装置能将化学能转化为电能 |
| C.电子由铜片通过导线流向锌片 |
| D.正极反应为:2H++2e-=H2↑ |
知反应:A(g)+B(g)=C(g)+D(g)的能量变化如图所示,下列说法正确的是
| A.若此反应过程中有电子转移,可设计成原电池 |
| B.该反应为吸热反应 |
| C.反应物的总能量高于生成物的总能量 |
| D.该反应只有在加热条件下才能进行 |
四种短周期元素在周期表中的位置如图所示,其中只有C为金属元素。下列说法错误的是
| A |
B |
||
| C |
D |
| A |
B |
||
| C |
D |
A.原子半径B<C
B.A的最高价氧化物对应水化物的酸性比D弱
C.D的最简单气态氢化物的热稳定性比B的小
D.B位于元素周期表中第二周期、第VIA族
将SO2通入含有酚酞的NaOH溶液中,发现溶液褪色,其原因主要是
| A.SO2具有漂白性 | B.SO2有氧化性 |
| C.SO2有还原性 | D.SO2中和了碱 |