三个容器中分别盛有H2、CH4、O2,已知三个容器中气体的温度、密度都相等,下列说法正确的是( )
| A.三种气体质量相等 | B.三种气体的物质的量之比为16∶2∶1 |
| C.三种气体压强比为16∶2∶1 | D.三种气体体积比为1∶8∶16 |
某化学科研小组研究在其他条件不变时,改变某一条件对A2(g)+3B2(g) 2AB3(g)化学平衡状态的影响,得到如下图所示的变化规律(图中T表示温度,n表示物质的量),根据如图可得出的判断结论正确的是()
2AB3(g)化学平衡状态的影响,得到如下图所示的变化规律(图中T表示温度,n表示物质的量),根据如图可得出的判断结论正确的是()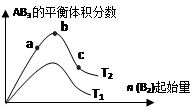
| A.反应速率a>b>c |
| B.达到平衡时,AB3的物质的量大小为:b > c > a |
| C.若T2>T1,则正反应一定是吸热反应 |
| D.达到平衡时A2的转化率大小为:b>a>c |
对于可逆反应 2AB3(g)  A2(g) + 3B2(g) (正反应吸热)下列图像正确的是()
A2(g) + 3B2(g) (正反应吸热)下列图像正确的是()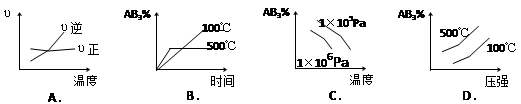
一定条件下,某容积不变的密闭容器内存在下列平衡:2HI(g) H2(g)+I2(g);则下列有关说法正确的是()
H2(g)+I2(g);则下列有关说法正确的是()
| A.如仅仅改变浓度这一条件,使得体系颜色加深,则上述平衡在条件改变之后的移动方向无法判断:即可以正移或逆移,还可以不移动 |
| B.如改变体系温度,体系颜色一定发生变化 |
| C.继续充入HI气体,则HI的转化率将减小 |
| D.温度不变时,当体系颜色变浅,则正反应速率和逆反应速率都将减小 |
在A+B(s) C的反应中,若增大压强或降低温度,B的转化率均增大,则反应体系应是()
C的反应中,若增大压强或降低温度,B的转化率均增大,则反应体系应是()
| A.A是固体、C是气体,正反应吸热 | B.A是气体、C是液体,正反应放热 |
| C.A是气体、C是气体,正反应放热 | D.A是气体、C是气体,正反应吸热 |
下图为某化学反应的速率与时间的关系示意图。在t1时刻升高温度或增大压强,速率的变化都符合示意图的反应是()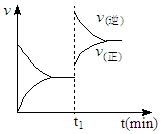
| A.2SO2(g)+O2(g) ⇌2SO3(g);ΔH<0 |
| B.4NH3(g)+5O2(g) ⇌4NO(g)+6H2O(g);ΔH<0 |
| C.H2(g)+I2(g) ⇌2HI(g); ΔH>0 |
| D.C(s)+H2O(g) ⇌CO(g)+H2(g);ΔH>0 |