(10分)CuI是难溶于水的白色固体。已知:氧化性Cu2+>I2>Cu+,还原性Cu>I->Cu+,氧化还原反应进行的方向是:较强氧化剂+较强还原剂→较弱还原产物+较弱氧化产物。
(1)根据物质氧化性、还原性的强弱推测,在溶液中Cu2+和I-反应的产物是________、________。
(2)久置于空气中的HI溶液呈黄色,向其中加入一些铜粉,可使溶液黄色消失,反应的化学方程式为___________________________________________________________
(3)欲消除(2)中HI溶液的黄色,也可向其中通入少量H2S,这是因为当浓度接近时,还原性H2S________(填“>”、“<”、“=”)I-;与加入铜粉的方法相比,用此方法得到的HI溶液浓度________(填“高”、“低”或“相等”)。
(4)CuI可用于监测空气中是否含有汞蒸气:4CuI(白色)+Hg===Cu2HgI4(亮黄色)+2Cu。下列关于该化学方程式的说法错误的是________。
a.该反应被氧化的元素是铜元素和汞元素
b.该反应的氧化剂为CuI
c.Cu2HgI4既是氧化产物又是还原产物
d.反应中转移电子 2 mol
A、B、C、D、E是除稀有气体以外的的5种短周期元素,原子序数依次增大并分占三个周期。B、C、D为同一周期依次相邻的3种元素,B和D的原子序数之比为3:4,E原子的电子层数等于最外层电子数。请回答相关问题:
(1)B元素在周期表中的位置_______________,C元素是__________(填元素符号)
(2)比较D和E简单离子半径的大小(用离子符号表示):__________________
(3)A和D形成的含18电子化合物的化学式为___________________
(4)元素E形成的简单离子的水溶液与C的氢化物的水溶液反应的离子方程式为:
_____________________________________________________________
(5)2007年7月2日,美、德两国科学家成功合成了具有独特化学特性的E2A6化合物,该物质在D2中能燃烧,写出它在D2中完全燃烧的化学方程式:
_____________________________________________________________
已知:①A是石油裂解气的主要成份,A的产量通常用来衡量一个国家的石油化工水平;②2CH3CHO+O2 2CH3COOH。
2CH3COOH。
③已知乳酸F的结构简式为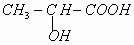 。
。
现以A为主要原料合成乙酸乙酯及高分子化合物E,其合成路线如下图所示
回答下列问题:(1)E的结构简式为
(2)F分子中含________和_________两种官能团(写名称)
(3)验证D和F兼有的官能团常采用的试剂是,产生的现象为
(4)写出下列反应的反应类型:①,④。
(5)写出下列反应的化学方程式:
①;
②;
③F与金属钠反应的化学方程式为
科学家们在探索生命奥秘的过程中,认识到生命细胞的组成和元素周期律有着密切的联系,约占人体总质量99.97%的11种大量元素全部位于元素周期表前20号元素,其余0.03%是由10多种人体不可缺少的微量元素组成。现有a~g 7种短周期元素,是除氧、硫、钾、钙外的其他大量元素,它们在元素周期表中的位置如下,请据此回答下列问题:
(1)元素的原子间反应最容易形成离子键的是下列中的(),元素的原子间反应容易形成共价键的是下列中的()
A.c和f B.b和g C.d和g D.d和e
|
(2)下列由a~g形成的各分子中,所有原子都满足最外层为8电子结构的是
A.ea3 B.ag C.fg3 D.dg4下列变化①碘的升华②烧碱熔化③氯化钠溶于水④氯化氢溶于水⑤氧气溶于水⑥氯化铵受热分解。未发生化学键破坏的是;仅发生离子键破坏的是_____;仅发生共价键破坏的是;既发生离子键又发生共价键破坏的是 。
在1×105Pa和298K时,将1mol气态AB分子分离成气态A原子和B原子所需要的能量成为键能(kJ·mol-1)。下面是一些共价键的键能:(已知氨分子中有三个等价的氮氢共价键)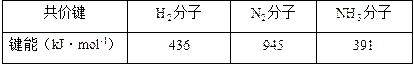
(1)根据上表中的数据判断工业合成氨的反应是___________(填“吸热”或“放热”)反应;
(2)在298K时,取1mol氮气和3mol氢气放入一密闭容器中,在催化剂存在下进行反应。理论上放出或吸收的热量为Q1,则Q1为______________;