已知短周期元素的离子aA2+、bB+、cC3-、dD-都具有相同的电子层结构,则下列叙述正确的是( )
| A.原子半径:A>B>D>C | B.原子序数:d>c>b>a |
| C.离子半径:C3->D->B+>A2+ | D.单质还原性:A>B>D>C |
已知25 ℃时,电离常数Ka(HF)=3.6×10-4mol·L-1,溶度积常数Ksp(CaF2)=1.46×10-10,Ksp(AgCl)=1.8×10-10,Ksp(AgI)=1.O×10一16。下列说法正确的是
| A.25 ℃时,O.1 mol·L-1 HF溶液pH=l,Ksp(CaF2)随温度和浓度的变化而变化 |
| B.向1 L0.2 mol·L-1 HF溶液中加入1 L O.2 mol·L-1 CaCl2溶液,没有沉淀产生 |
| C.AgCl不溶于水,不能转化为AgI |
D.常温下,AgCl若要在NaI溶液中开始转化为AgI,则NaI的浓度必须不低于 mol·L-1 mol·L-1 |
日本一家公司日前宣布,他们已经开发并计划大量生产一种颠覆性的阳极和阴极都是碳材料的双碳性电池(放电原理示意如图所示),充电速度比普通的锂离子电池快20倍。放电时,正极反应Cn(PF6)+e-=PF6-+nC,负极反应:LiCn-e-=Li++nC,下列有关说法中正确的是
| A.a极为电池的负极 |
| B.A一为OH- |
| C.电池充电时阴极反应为:LiCn+e-=Li++nC |
| D.充电时,溶液中A一从b极向a极迁移 |
下列图示实验正确的是
A.测量Cu与浓硝酸反应产生气体的体积: |
B.验证Na和水反应为放热反应: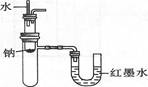 |
C.制取干燥的氨气: |
D.收集H2 |
设NA为阿伏加德罗常数的值,下列说法正确的是
| A.标准状况下,18 g H20所含的中子数为10NA |
| B.一定条件下1 mol铁粉与浓硫酸反应,转移电子数一定为3NA |
| C.在1 L的碳酸钠溶液中,若c(CO32一)="1" mol·L-1,则Na+数目大于2NA |
| D.含阴阳离子总数为4NA的固体Na202溶于水配成1 L溶液,所得溶液Na+的物质的量浓度2 mol·L-1 |
下列离子方程式书写正确的是
A.小苏打溶液呈碱性的原因: |
B.向氢氧化亚铁中加入足量稀硝酸: |
C.将含等物质的量的NaHCO3和Ba(OH)2溶液混合:  |
D.少量A1Cl3溶液滴入过量氨水中: |