氢气在氯气中燃烧时产生苍白色火焰。在反应过程中,破坏1mol氢气中的化学键消耗的能量为Q1kJ,破坏1mol氯气中的化学键消耗的能量为Q2kJ,形成1mol氯化氢中的化学键释放的能量为Q3kJ。下列关系式中,正确的是( )
| A.Q1+Q2>Q3 | B.Q1+ Q2>2Q3 | C.Q1+Q2<Q3 | D.Q1+ Q2<2Q3 |
下列各表述与示意图一致的是
| A.图①表示室温时,用0.1 mol.L-1盐酸滴定0.1 mol·L-1NaOH溶液过程中的pH变化 |
B.T℃时,反应2NO2(g) N2O4(g)达到平衡时NO2的体积分数 N2O4(g)达到平衡时NO2的体积分数 (NO2)随压强P的变化如图②所示,则A点的颜色深,B点的颜色浅 (NO2)随压强P的变化如图②所示,则A点的颜色深,B点的颜色浅 |
C.图③表示向绝热恒容密闭容器中通入A2和B2,一定条件下使反应2A2(g)+B2(g) 2C(g),达到平衡,正反应速率随时间变化的示意图。由图可得出的结论是:反应物的总能量低于生成物的总量 2C(g),达到平衡,正反应速率随时间变化的示意图。由图可得出的结论是:反应物的总能量低于生成物的总量 |
D.图④在恒温恒容的密闭容器中,气体M存在如下关系xM(g) Mx(g),t1时刻,保持温度不变,再充入1 mol M,重新达到平衡时 Mx(g),t1时刻,保持温度不变,再充入1 mol M,重新达到平衡时 将增大 将增大 |
利用钠碱循环法可脱除烟气中的SO2。在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得。当吸收液的pH降至约为6时,需送至电解槽再生。再生示意图如下:
下列有关上述过程的说法错误的是
| A.NaOH溶液吸收SO2制得Na2SO3溶液的离子方程式:2OH-+SO2=SO32-+H2O |
| B.当吸收液呈中性时,溶液中的离子浓度满足:c(Na+)=2c(SO32-)+c(HSO3-) |
C.吸收液吸收SO2的过程中,pH与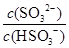 的大小成反比 的大小成反比 |
| D.HSO3-在阳极放电时的电极反应式:HSO3-+H2O-2e-=S042- +3H+ |
下列叙述正确的是
A.已知I3- I2+I-,向盛有KI3溶液的试管中加入适量CCl4,振荡静置后CCl4层显紫红色,说明KI3在CCl4中的溶解度比在水中的大 I2+I-,向盛有KI3溶液的试管中加入适量CCl4,振荡静置后CCl4层显紫红色,说明KI3在CCl4中的溶解度比在水中的大 |
B.室温下向10mL pH =3的醋酸溶液中加水稀释后,溶液中 减小 减小 |
| C.室温时ka(HF)=3.6×10-4,ka(CH3COOH)=1.75×10-5,0.1 mol /L的NaF溶液与0.1 mol /L的CH3COOK溶液相比,一定有c(Na+) -c(F-)<c(K+)-c(CH3COO-)成立 |
D.在25℃时,将amol/L的氨水与0.01 mol/L的盐酸等体积混合,充分反应后溶液中c(NH4+)=c(Cl-),则25℃时NH3 • H2O的电离常数Kb= |
下列叙述不正确的是
| A.实验I :反应开始时反应速率由慢变快,再变慢 |
| B.实验II :滴加几滴浓H2SO4后,溶液颜色由黄色变为橙色 |
| C.实验III:由该实验可以验证催化剂的催化效果 |
| D.实验IV:能验证AgCl沉淀可转化为溶解度更小的Ag2S沉淀 |
下列离子方程式中,不正确的是
| A.将氯气溶于水:Cl2+H2O=2H++Cl-+ClO- |
| B.AlCl3溶液中加入过量氨水:Al3++3NH3·H2O=Al(OH)3↓+3NH4+ |
| C.FeBr2溶液中通入过量的Cl2:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl- |
| D.向Fe(NO3)2溶液中加入稀盐酸:3Fe2++4H++NO3-=3Fe3++NO↑+2H2O |