设NA为阿伏伽德罗常数的数值,下列说法正确的是( )
| A.标准状况下,22.4L二氯甲烷含有NA个二氯甲烷分子 |
| B.1L 0.1mol/L乙酸溶液中H+数为0.1NA |
| C.17.6g丙烷中所含的极性共价键为3.2 NA个 |
| D.1mol Na2O2固体中含离子总数为4 NA |
将22.4g金属粉末混合物,放入足量的稀H2SO4中至无气泡产生为止,共收集到标准状况下的H2 22.4L,此混合物可能是()
| A.锌和铜 | B.镁和铁 | C.铝和锂 | D.锌和铝 |
下图装置可用于制取、提纯并收集表格中的四种气体(a、b、c表示相应仪器中加入的试剂),其中可行的是()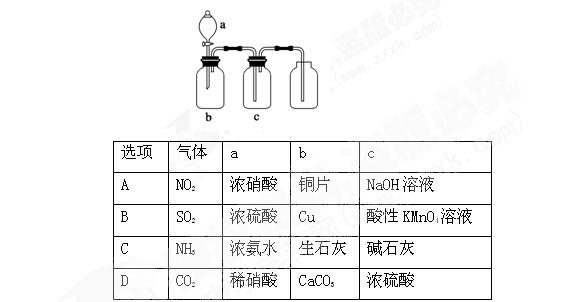
已知Co2O3在酸性溶液中易被还原成Co2+,且Co2O3、Cl2、FeCl3、I2的氧化性依次减弱。下列反应在水溶液中不可能发生的是()
| A.2Fe3++2I-===2Fe2++I2 | B.Cl2+FeI2===FeCl2+I2 |
| C.Co2O3+6HCl===2CoCl2+Cl2↑+3H2O | D.3Cl2+6FeI2===2FeCl3+4FeI3 |
化学学习方法中的类推法是由已学知识通过迁移构建新知识的方法。下列类比正确的是()
A.CaCO3与稀硝 酸反应生成CO2,CaSO3也能与稀硝酸反应生成SO2 酸反应生成CO2,CaSO3也能与稀硝酸反应生成SO2 |
| B.铜在氯气中剧烈燃烧生成二价铜,铜也能在硫蒸气中剧烈燃烧生成二价铜 |
| C.锌可以与溶液中的银离子发生置换反应,钠也能与溶液中的银离子发生置换反应 |
| D.钠与乙醇反应产生氢气,钾与乙醇也能反应产生氢气 |
用NA表示阿伏加德罗常数的值,下列说法正确的是()
| A.在0℃,压强为1.01×105Pa时,22.4L Cl2与HCl的混合气体中含有的氯原子总数为3NA |
| B.0.5molI—被氧化时失去的电子数为0.5NA |
| C.常温常压下,48gO3含有氧原子数为3NA |
| D.0.1L3 mol·L-1的NH4NO3溶液中含有的NH4+数目为0.3NA |