A、B、C、D、E是核电荷数依次增大的五种短周期主族元素,A元素的原子核内只有1个质子,B元素的原子半径是其所在主族中最小的,B的最高价氧化物对应水化物的化学式为HBO3;C元素原子的最外层电子数比次外层多4个;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化合物D2C;C、E主族.
(1)B在周期表中的位置 ;
(2)E元素形成的最高价氧化物对应的水化物的化学式为 ;
(3)元素C、D、E形成的离子半径大小关系是 > > (用离子符号表示)。
(4)用电子式表示化合物D2C的形成过程 。
C、D还可形成化合物D2C2,D2C2含有的化学键是 。
(5)由A、B、C三种元素形成的离子化合物的化学式为 。
由A、B元素组成的含4个原子核和42个电子的-2价阳离子中,1个A的核内质子数比B的核内质子数多8个,试通过计算确定:
(1)A、B元素名称分别为和。
(2)写出该阴离子的离子符号。
(3)该阴离子与钠离子形成的化合物中含有键。
A、B、C、D、E是中学化学常见的分子或离子,它们具有相同的电子数,且A是由5个原子核组成的粒子。它们之间可发生如下变化,且D与酸性氧化物、碱性氧化物均能反应。
A+B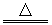 C+D B+E====2D
C+D B+E====2D
(1)写出A的电子式______________。
(2)写出B的化学式______________。
(3)写出D的电子式______________。
已知离子键的键能与阴阳离子的电荷乘积成正比,与离子间的距离平方(可视为阴阳离子半径之和)成反比,若阳离子是Na+、K+、Rb+、Cs+,则其氯化物的熔点高低顺序是:____________。
已知氯化铝的熔点为190 ℃(2.02×105 Pa),但它在180 ℃即开始升华。
(1)氯化铝是__________ (填“离子化合物”或“共价化合物”)。
(2)在500 K和1.01×105 Pa时,它的蒸气密度(换算成标准状况时)为11.92 g·L-1,氯化铝的化学式为____________________________________________________________。
(3)无水氯化铝在空气中强烈地“发烟”,其原因是与水反应生成了HCl,写出该反应的化学方程式____________________________________________________________。
(4)设计一个更可靠的实验,判别氯化铝是离子化合物还是共价化合物。你设计的实验是______________________________________________________________________。
试推断下列化合物的化学式:
(1)X、Y两元素能形成XY2型化合物,XY2中共有38个电子,若XY2是离子化合物,其化学式是__________或__________;若XY2是共价化合物,其化学式是__________。
(2)第3周期内,A、B两元素的原子序数之差为4,它们组成的化合物AB的化学式为________。
(3)1 mol 某物质含有不同周期的三种元素各1 mol,其核电荷总数为20 mol,该物质的化学式为__________。
(4)某非金属X的最高正化合价为+m,它的最高正价氧化物对应的水化物形成的酸中有b个氧原子,则这种酸的化学式是__________。
(5)X元素的最高正价和负价绝对值之差为6;Y元素和X元素原子的次外电子层上都有8个电子;X和Y形成的化合物在水溶液中能电离出电子层结构相同的离子。则X和Y所形成的化合物是__________。