已知H2+I2 2HI △H<0。有相同容积的定容密封容器甲和乙,甲中加入H2和I2各0.1mol,乙中加入HI 0.2mol,相同温度下分别达到平衡。欲使甲中HI的平衡浓度大于乙中HI的平衡浓度,应采取的措施是
2HI △H<0。有相同容积的定容密封容器甲和乙,甲中加入H2和I2各0.1mol,乙中加入HI 0.2mol,相同温度下分别达到平衡。欲使甲中HI的平衡浓度大于乙中HI的平衡浓度,应采取的措施是
| A.甲、乙提高相同温度 |
| B.甲中加入0.1 molHe,乙不改变 |
| C.甲降低温度,乙不变 |
| D.甲增加0.1 molH2,乙增加0.1 mol I2 |
下列离子方程式中正确的是
| A.在硫酸铜溶液中加入过量氢氧化钡溶液 Ba2++SO42—=BaSO4↓ |
| B.二氧化碳通入碳酸钠溶液中 CO2+CO32—+H2O =2HCO3— |
| C.金属钠投入水中 Na + 2H2O= Na+ + 2OH- + H2↑ |
| D.氯气通入冷的氢氧化钠溶液中 2Cl2+2OH-= 3Cl-+ClO-+H2O |
实验是研究化学的基础,下图中所示的实验方法、装置或操作完全正确的是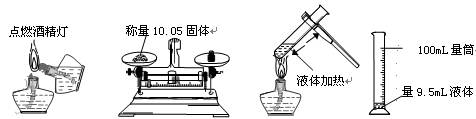
A B C D
下列说法正确的是
| A.1H、2H、3H互为同素异形体 | B.S2、S6互为同位素 |
| C.正丁烷和异丁烷互为同分异构体 | D.乙烷、乙烯互为同系物 |
NA为阿伏加德罗常数,下列叙述正确的是
| A.80g硝酸铵中含有氮原子数为NA |
| B.16 g氧气和16 g臭氧所含的原子数均为NA |
| C.2mol金属铝与足量的盐酸反应,共失去了4NA个电子 |
| D.0.l mol N2分子中所含的电子数为7NA |
下列离子在水溶液中能大量共存的一组是
| A.Ca2+、CO32-、SO42- | B.Fe2+、NO3-、H+ |
| C.NH4+、Cl-、HCO3- | D.K+、H+、OH- |