(每空2分,共8分)熔融盐燃料电池具有高的发电效率,因而受到重视。某燃料电池以熔融的K2CO3(其中不含O2-和HCO3-)为电解质,以丁烷为燃料,以空气为氧化剂,以具有催化作用和导电性能的稀土金属材料为电极。该燃料电池负极电极反应式为:
2C4H10+26CO32--52e-=34CO2+10H2O
试回答下列问题:
(1)该燃料电池的化学反应方程式为 ;
(2)正极电极反应式为 。
(3)为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定。为此,必须在通入的空气中加入一种物质,加入的物质是 ,它来自 。
下表是元素周期表的一部分,用元素符号或化学式回答下列有关问题:

(1)写出下列元素符号:⑥ ________,⑨________。
(2)画出原子的结构示意图:② ________,⑤________。
(3)在这些元素中,最活泼的金属元素是________,最活泼 的非金属元素是________,二者形成的化合物的电子式为
的非金属元素是________,二者形成的化合物的电子式为
(4)在这些元素的最高价氧化物对应水化物中,酸性最强的是________,碱性最强的是________、具有两性的是。
一定条件下的可逆反应2NO2 (g)  N2O4 (g) △H=" -92.4kJ/mol" 达到化学平衡状态且其它条件不变时,
N2O4 (g) △H=" -92.4kJ/mol" 达到化学平衡状态且其它条件不变时,
(1)如果升高温度,平衡混合物的颜色;(变深、变浅)
(2)如果在体积固定的容器中加入一定量的二氧化氮,化学平衡向方向移动。
可逆反应:aA(g)+ bB(g) cC(g)+ dD(g);根据图回答:
cC(g)+ dD(g);根据图回答: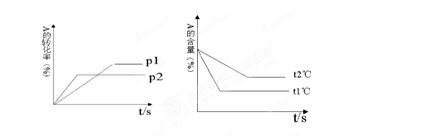
(1)压强 P1比P2(填大或小);
(2)(a +b)比(c +d)(填大或小);
(3)温度t1℃比t2℃(填高或低);(4)正反应为反应。
(8分)某学生利用以下装置探究氯气与氨气之间的反应。其中A、F分别为氨气和氯气的发生装置,C为纯净干燥的氯气与氨气反应的装置。
请回答下列问题:
(1)装置F中发生反应的离子方程式为__________________________________________。
(2) B装置的名称是___________________;E装置的作用__________________________。
(3)通入C装置的两根导管左边较长、右边较短,目的是___________________________。
(4)装置C内出现浓厚的白烟并在容器内壁凝结,另一生成物是空气的主要成分之一。请写出反应的化学方程式:________________________________________________。
(14分). 复印机使用的墨粉主要成分是Fe3O4,下图是氧化沉淀 法生产Fe3O4的工艺:
法生产Fe3O4的工艺: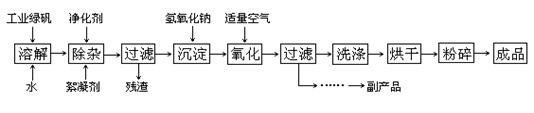
已知:① 工业绿矾中FeSO4的含量为52.5%,其中的杂质不参与反应;
② Fe(OH)2+2Fe(OH)3=Fe3O4·4H2O
③ 12.16﹡1000﹡52.5%=6384,6384/152=42请回答下列问题:
(1)铁的常见氧化物有;
(2)Fe3O4与稀硝酸反应的离子方程式是,检验反应后的溶液中含Fe3+的方法;
(3)在工艺流程中,通入适量空气“氧化”时的化学方程式是:;
(4)生产中可获得的副产品是,提取该副产品的操作顺序是(填写序号)
a.过滤 b.加热浓缩 c.冷却 d.结晶 e.洗涤
(5)在生产过程中,若工业绿矾的投料速率是12.16 kg/h,为使产品较纯,鼓入空气的速率应为L/h(假设反应在标准状态下进行,空气中O2占20%)。