(每空2分,共14分)在锌与盐酸反应的实验中,某同学得到的结果如下表所示:
| |
锌的质量/g |
锌的形状 |
温度/℃ |
完全溶于水的时间/s |
| A |
2 |
薄片 |
5 |
400 |
| B |
2 |
薄片 |
15 |
200 |
| C |
2 |
薄片 |
25 |
100 |
| D |
2 |
薄片 |
35 |
t1 |
| E |
2 |
颗粒 |
15 |
t2 |
| F |
2 |
粉末 |
15 |
t3 |
| G |
2 |
薄片(含少量杂质Cu) |
35 |
t4 |
(1)t1= s,在答题卷的方框内画一幅以时间对温度的曲线图(纵轴表示时间,横轴表示温度)。
(2)利用所画的曲线图,关于温度影响反应速率的结论是 。
(3)t1 (填“>”或“<”)t4,原因是 。t2 t3(填“>”或“<”),原因是 。
实验室用固体烧碱配制500mL0.1000mol/L的NaOH溶液。
(1)需称量___________g烧碱,应放在_____________(填仪器名称)中称量
(2)配制过程中,不需要的仪器(填写代号)____________________
a、烧杯 b、量筒 c、玻璃棒 d、1000mL容量瓶 e、漏斗 f、胶头滴管
(3)根据实验需要和(2)所列仪器判断,完成实验还缺少的仪器是____________,___________,________。
(4)步骤B通常称为转移,步骤A通常称为
(5)将上述实验步骤A到F按实验过程先后次序排列
(6)在容量瓶中确定溶液体积的过程中,最后加入少量水的操作是______________________
有一种工业废水,已知其中含有大量的FeSO4,少量的Ag+和Na+,以及部分污泥。现设计了一个既经济又合理的方法以回收金属银、硫酸亚铁。以下列出实验步骤,试说明每一步骤的目的(不必写化学方程式)。
(1)过滤
(2)滤液中加入过量铁粉
(3)过滤
(4)将混有铁粉的Ag用稀硫酸处理,
(5)过滤
(6)将第(3)和(5)步的滤液合并,蒸发浓缩,冷却,
(7)过滤,
选择下列实验方法分离物质,将分离方法的序号填在横线上
A 萃取分液法 B 结晶法 C 分液法 D 蒸馏法 E 过滤法 F 升华
①_____分离饱和食盐水与沙子的混合物。
②_____分离水和汽油的混合物。
③______分离四氯化碳(沸点为76.75℃)和甲苯(沸点为110.6℃)的混合物。
④_____从碘的水溶液里提取碘。
⑤______从硝酸钾和氯化钠的混合液中获得硝酸钾。
⑥分离氯化钠晶体和碘单质。
(1)某同学用托盘天平称量烧杯的质量,天平平衡后的状态如图。由图中可以看出,该同学在操作时的一个错误是_____,烧杯的实际质量为___g.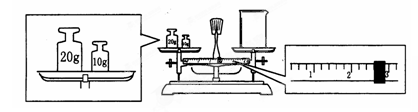
(2)指出下面实验中存在的二个错误:
A.需配制250 mL 0.2 mol/LNaCl溶液,题右图是该同学转移溶液的示意图。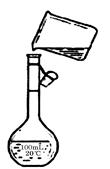
、
用 NH4Cl进行如下实验,试判断发生的现象,并简单说明原因。
(1) 用玻璃棒蘸取少量 NH4Cl溶液与pH试纸接触时,试纸显示的颜色与标准比色卡相比,可发现 NH4Cl溶液的pH 7(填“<”、“=”或“>”),显性(填“酸”、“碱”或“中”),其原因可用离子方程式表示为;
(2)在NH4Cl溶液中加入镁粉,可观察到有气体生成,其主要成分为。
(3) 25℃时,向0.1mol/L的氨水中加入少量氯化铵固体,当固体溶解后,测得溶液pH减小,主要原因是(填序号)。
A.氨水与氯化铵发生化学反应 B.氯化铵溶液水解显酸性,增大了c(H+)
C.氯化铵溶于水,电离出大量铵离子,抑制了氨水的电离,使c(OH―)减小