可逆反应:2NO2(g)  2NO(g)+ O2(g),在体积不变的密闭容器中反应,达到平衡状态的标志是:( )
2NO(g)+ O2(g),在体积不变的密闭容器中反应,达到平衡状态的标志是:( )
①单位时间内生成n mol O2的同时生成2n mol NO2 ②单位时间内生成n mol O2的同时生成2n mol NO ③用NO2、NO、O2的物质的量浓度变化表示的反应速率之比为2:2:1的状态 ④混合气体的颜色不再改变的状态⑤混合气体的密度不再改变的状态
| A.①④ | B.②③⑤ | C.①③④ | D.①②③④⑤ |
As2S3和HNO3有如下反应:As2S3 + 10H+ + 10NO3- 2H3AsO4 + 3S + 10NO2↑+ 2H2O,下列说法正确的是
2H3AsO4 + 3S + 10NO2↑+ 2H2O,下列说法正确的是
| A.生成1mol H3AsO4时,转移电子个数为10NA |
| B.将该反应设计成一原电池,则NO2应该在正极附近逸出 |
| C.该反应的氧化产物之一为S |
| D.反应产物NO2与11.2LO2(标准状况)混合后用水吸收全部转化为浓HNO3,然后与过量的碳反应,所产生的CO2的量为0.5mol |
水溶液中只可能有K+、Mg2+、AlO2-、Al3+、SiO32-、CO32-、SO42-中的若干种离子。某同学对溶液进行了如下实验: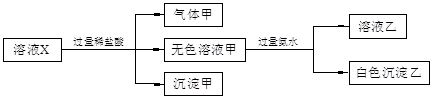
下列判断错误的是
| A.有气体甲生成,表明溶液X中一定含有CO32- |
| B.沉淀甲不可能是硅酸镁 |
| C.Al3+一定存在于溶液X中 |
| D.不可能确定SO42-是否存在于溶液X中 |
已知:25℃时,CaCO3的Ksp为2.9×10-9,CaF2的Ksp为2.7×10-11下列说法正确的是
| A.25℃时,饱和CaCO3溶液与饱和CaF2溶液相比,后者Ca2+浓度大 |
| B.25℃时,饱和CaCO3溶液与饱和CaF2溶液等体积混合,会析出CaCO3固体 |
| C.25℃时,CaCO3固体在20mL0.01mol·L-1盐酸中的Ksp比在20mL0.01mol·L-1氨水中的Ksp大 |
| D.25℃时,在CaCO3悬浊液中加入NaF固体,CaCO3不可能全转化为CaF2 |
有甲、乙两个完全相同的装置,分别在它们的侧管中装入1.06 g Na2CO3和0.84 g NaHCO3,试管中各有10 mL相同浓度的盐酸(如下图),同时将两个侧管中的物质全部倒入各自的试管中,下列叙述正确的是
| A.甲装置的气球膨胀速率大 |
| B.若最终两气球体积相同,则一定有c(HCl)≥2 mol/L |
| C.若最终两气球体积不同,则一定有c(HCl)≤1 mol/L |
| D.最终两溶液中Na+、Cl-的物质的量相同 |
某芳香化合物的分子式为C8H8Cl2O2,其分子结构中有三种不同化学环境的氢,它们的数目之比为6︰1︰1,且分子中的Cl原子皆形成C-Cl键,则其可能的结构有(不考虑O与O相连接)
| A.2种 | B.3种 | C.4种 | D.5种 |