下列化学实验事实及解释都正确的是
| A.用滴有少量硫酸铜溶液的稀硫酸跟锌粒反应快速地制氢气,说明Cu2+具有催化能力 |
| B.升高温度会加快化学反应速率,其原因是增加了单位体积内活化分子的百分数 |
C.等体积、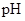 都为3的酸HA和HB分别与足量的锌反应,HA放出的氢气多,说明酸性: 都为3的酸HA和HB分别与足量的锌反应,HA放出的氢气多,说明酸性: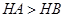 |
D.向浓度均为0.1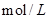 的MgCl2、CuCl2混合溶液中逐滴加入少量氨水,先生成Cu(OH)2沉淀,说明 的MgCl2、CuCl2混合溶液中逐滴加入少量氨水,先生成Cu(OH)2沉淀,说明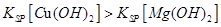 |
下列各组有机物中,仅使用溴水不能鉴别出来的是
| A.苯、四氯化碳 | B.乙炔、乙烯 |
| C.乙烷、乙烯 | D.苯、酒精 |
下列物质中,只有一种分子的是
| A.二溴甲烷 | B.分子组成为C2H6O的有机物 |
| C.聚乙烯 | D.分子组成为C4H10的有机物 |
下列物质中,属于高分子化合物的是①蛋白质②氨基酸③油脂④淀粉⑤氯乙烯⑥纤维素⑦聚乙烯
| A.只有①② | B.除②外都是 |
| C.只有①④⑥⑦ | D.只有①③ |
下列物质中,在一定条件下能和NaOH溶液发生反应的是
| A.乙醇 | B.甲苯 | C.油脂 | D.汽油 |
下列关于有机化合物存在的叙述中,错误的是
| A.工业酒精中含有乙醇和甲醇 | B.许多水果中含有酯类化合物 |
| C.天然油脂中含有高级脂肪酸甘油酯 | D.煤中含有苯 |