一定温度下,4个容器均为1L的容器中,分别进行反应:C(s)+H2O(g) 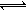 CO(g)+H2(g) △H=+131.3KJ.mol-1[各容器中C(s)均足量],在某时刻测得有关物质的浓度及正、逆反应速率的关系如下表。下列说法不正确的是
CO(g)+H2(g) △H=+131.3KJ.mol-1[各容器中C(s)均足量],在某时刻测得有关物质的浓度及正、逆反应速率的关系如下表。下列说法不正确的是 
| A.在容器Ⅱ中,v(正)<v(逆) |
| B.在容器Ⅳ中,H2的浓度为0.40 mol.L-1 |
| C.在容器Ⅲ中, 反应达到平衡时吸收的热量为13.13 KJ |
| D.若将平衡时容器Ⅰ、Ⅳ中的物质混合于容积为1L的容器中,则反应仍处于平衡状态 |
下列有关物质检验的实验结论正确的是
| 选项 |
实验操作及现象 |
实验结论 |
| A |
Fe粉与水蒸气加热,产生气体通入肥皂水冒泡 |
反应生成H2 |
| B |
向某溶液中加入盐酸酸化的BaCl2溶液,有白色沉淀生成 |
溶液中一定含有SO42- |
| C |
向装有Fe(NO3)2溶液的试管中加入稀H2SO4,在管口观察到红棕色气体 |
HNO3分解生成了NO2 |
| D |
将某未知溶液作焰色反应来鉴定所含金属元素,肉眼直接观察到黄色火焰 |
溶液中含钠元素,但不能确定是否含钾元素 |
下列实验装置图所示的实验操作,不能达到相应实验目的的是
下列各组离子能大量共存于同一溶液中,并且加入NaOH溶液或稀硫酸时,都能产生白色沉淀的是
| A.Ca2+、Mg2+、NO3-、CO32- | B.Na+、Al3+、Cl-、Ag+ |
| C.Ba2+、K+、Mg2+、Cl- | D.NH4+、Na+、K+、Cl- |
下列应用或解释合理的是
| A.丁达尔效应是区分胶体和溶液的一种常用物理方法 |
| B.SO2具有漂白性,可使紫色石蕊试液褪为无色 |
| C.氯化钠溶液显中性,可用铝制容器贮存氯化钠溶液 |
| D.在实验室里,常用电解饱和食盐水的方法制取氯气 |
用NA表示阿伏加德罗常数的值,下列说法正确的是
| A.标准状况下,11.2 LO2和O3组成的混合气体含有原子数为NA |
| B.常温常压下,1.7 g NH3含有的电子数目为 NA |
| C.0.1mol/LNa2SO4溶液中含有Na+的个数为0.2NA |
| D.常温常压下,22.4 LCO2与足量Na2O2反应转移电子数为 NA |