右图为直流电源电解稀Na2SO4水溶液的装置,在电极a和b附近分别滴加石蕊溶液,通电后在a极收集到c mol气体,下列叙述正确的是( ) 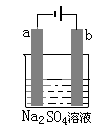
| A.若两极均为石墨电极,则消耗水为2c mol |
| B.若两极均为铜电极,则消耗水为2c mol |
| C.a电极附近呈红色,b电极附近呈蓝色 |
| D.电极逸出无味气体,另一电极逸出刺激性气味气体 |
下列反应中生成物的总能量大于反应物总能量的非氧化还原反应是
| A.铝热反应 | B.氯化铝溶液的水解 |
| C.氢氧化钠和盐酸反应 | D.焦炭在高温下与水蒸气反应 |
下列各装置中都盛有0.1 mol·Lˉ1的NaCl溶液,放置一定时间后,纯锌片的腐蚀速率由快到慢的顺序是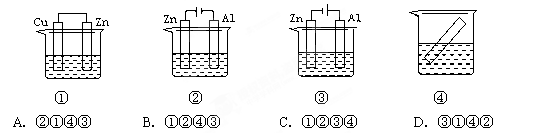
下列事实不能用勒夏特列原理解释的是
| A.热的纯碱溶液比冷的纯碱溶液洗涤油污效果更好 |
| B.配制FeCl3溶液时,在溶液中加入少量稀盐酸 |
| C.等质量粉末状与块状碳酸钙分别与同浓度的盐酸反应,粉末状比块状的反应快 |
| D.新制的氯水在光照条件下颜色变浅 |
已知在t1、t2温度下水的电离平衡曲线如图所示,则下列说法中不正确的是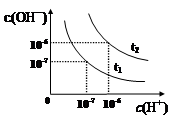
| A.t1<t2 |
| B.一定温度下,改变水溶液中c(H+)或 c(OH-)的浓度,Kw不会发生变化 |
| C.t2温度pH值为2的HCl溶液中,水电离出的c(H+)=1×10-10mol·L-1 |
| D.将t1温度下0.1 mol·L-1的盐酸稀释,溶液中所有离子的浓度均相应减小 |
常温下,0.1 mol·L-1某一元酸(HA)溶液中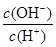 =10-8,下列叙述正确的是
=10-8,下列叙述正确的是
A.该一元酸溶液的pH=1
B.该溶液中由水电离出的H+浓度为c(H+)=1.0×10-11 mol·L-1
C.该溶液中水的离子积常数为1.0×10-22
D.在0.1 mol·L-1某一元酸(HA)溶液中,水的电离被促进