说明可逆反应A(g)+B(g) C(g)+D(g)在一定条件下已达到平衡的事实是
C(g)+D(g)在一定条件下已达到平衡的事实是
A 容器内压强不随时间的变化而变化 B 容器内A、B、C、D四者共存
C A、D的消耗速率相等 D D、C的生成速率相等
某固体酸燃料电池以CsHSO4固体为电解质传递H+,其基本结构如图,电池总反应可表示为:2H2+O2=2H2O,下列有关说法正确的是( )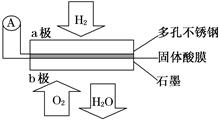
| A.电子通过外电路从b极流向a极 |
| B.b极上的电极反应式为: O2+2H2O+4e-=4OH- |
| C.每转移0.1 mol电子,消耗1.12 L的H2 |
| D.H+由a极通过固体酸电解质传递到b极 |
下列有关金属腐蚀与防护的说法正确的是( )
| A.纯银器表面在空气中因化学腐蚀渐渐变暗 |
| B.当镀锡铁制品的镀层破损时,镀层仍能对铁制品起保护作用 |
| C.在海轮外壳连接银块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法 |
| D.可将地下输油钢管与外加直流电源的正极相连以保护它不受腐蚀 |
铜锌原电池(如图)工作时,下列叙述正确的是( )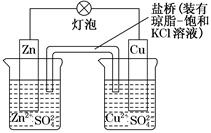
| A.正极反应为:Zn―→Zn2++2e- |
| B.电池反应为:Zn+Cu2+=Zn2++Cu |
| C.在外电路中,电子从正极流向负极 |
| D.盐桥中的K+移向ZnSO4溶液 |
断裂下列化学键需要吸收的能量分别为:H-H:436 kJ/mol F-F:153 kJ/mol H-F:565 kJ/mol,下列说法正确的是( )
| A.H2与F2反应的热化学方程式为: H2(g)+F2(g)=2HF(g) ΔH=-541 kJ |
| B.2 L HF气体分解成1 L H2和1 L F2吸收541 kJ的热量 |
| C.1 mol H2与1 mol F2反应生成2 mol液态HF放出的热量小于541 kJ |
| D.在相同条件下,1 mol H2与1 mol F2的能量总和大于2 mol HF气体的能量 |
在一定条件下,将64 g二氧化硫气体氧化成三氧化硫气体时,实验测得放出热量为78.64 kJ,已知二氧化硫在此条件下的转化率为80%。下列热化学方程式书写正确的是( )
A.SO2(g)+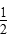 O2(g) O2(g)  SO3(g)ΔH=-98.3 kJ·mol-1 SO3(g)ΔH=-98.3 kJ·mol-1 |
B.2SO2(g)+O2(g)  2SO3(l)ΔH=-196.6 kJ·mol-1 2SO3(l)ΔH=-196.6 kJ·mol-1 |
C.SO2(g)+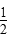 O2(g) O2(g)  SO3(g)ΔH=-78.64 kJ·mol-1 SO3(g)ΔH=-78.64 kJ·mol-1 |
D.2SO2(g)+O2(g)  2SO3(g)ΔH=+196.6 kJ·mol-1 2SO3(g)ΔH=+196.6 kJ·mol-1 |