下列反应中既是分解反应又属于氧化还原反应的是( )
A.C + O2 CO2 CO2 |
B.CaCO3 CaO + CO2↑ CaO + CO2↑ |
C.2KMnO4 K2MnO4+ MnO2 + O2 ↑ K2MnO4+ MnO2 + O2 ↑ |
| D.Zn+H2SO4=ZnSO4+H2↑ |
2004年7月德俄两国化学家共同宣布,在高压下氮气会聚合生成高聚氮,这种高聚氮的晶体中每个氮原子都通过三个单键与其它氮原子结合并向空间发展构成立体网状结构。则下列有关说法不正确的是
| A.高聚氮晶体属于分子晶体 | B.高聚氮转化为N2是化学变化 |
| C.高聚氮是N2的一种同素异形体 | D.做炸药或高能材料可能是高聚氮潜在的应用 |
已知H 2(g)、C 2H 4(g)和C 2H 5OH(1)的燃烧热(燃烧热:1mol可燃物完全燃烧,生成稳定化合物即碳元素转化为CO 2,氢元素转化为液态水时放出的热量)分别是-285.8kJ·mol -1、-1411.0kJ·mol -1和-1366.8kJ·mol -1,则反应C 2H 4(g)+H 2O(l)=C 2H 5OH(l)的△ H为
| A. | +44.2kJ·mol -1 | B. | - 44.2kJ·mol -1 | C. | +330kJ·mol -1 | D. | -330kJ·mol -1 |
2007年诺贝尔化学奖得主Gerhard Ertl对金属Pt表面催化CO氧化反应的模型进行了深入研究。下列关于 Pt的说法正确的是
Pt的说法正确的是
A. Pt和 Pt和 Pt是同一种核素 Pt是同一种核素 |
B. Pt和 Pt和 Pt互称为同位素 Pt互称为同位素 |
C. Pt和 Pt和 Pt的性质完全相同 Pt的性质完全相同 |
D. Pt和 Pt和 Pt互称为同分异构体 Pt互称为同分异构体 |
X、Y、Z、W都是短周期主族元素。其中X原子最外层电子数是内层电子总数的3倍;X、Z同族,Y、Z同周期,W与X、Y既不同族也不同周期;X、Y、Z三种原子的最外层电子数之和为19。下列说法正确的是
| A.Y元素最高价氧化物对应水化物的化学式为:HYO3 |
B.X、Y、Z形成的简单离子的半径大小为:Y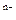 >Z >Z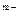 >X >X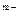 |
| C.元素X、Z分别与元素W形成的化合物的沸点为:WmX<WmZ |
| D.相同条件下,等物质的量浓度HnY溶液的酸性比HmZ溶液的酸性强 |
《化学教育》报道了数起因食用有“瘦肉精”的猪肉和内脏,而发生急性中毒的恶性事件。这足以说明,目前由于奸商的违法经营,已使“瘦肉精”变成了“害人精”。“瘦肉精”的结构表示如下图,下列关于“瘦肉精”的说法中正确的是
| A.化学式为C12H19Cl3N2O |
| B.属于芳香烃 |
| C.其催化氧化产物能发生银镜反应 |
| D.不能发生加成反应 |