(10分)能源短缺是人类社会面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上一般采用下列两种反应合成甲醇:
反应I: CO(g)+2H2(g)  CH3OH(g) ΔH1
CH3OH(g) ΔH1
反应II:CO2(g)+3H2(g) CH3OH(g) + H2O(g) ΔH2
CH3OH(g) + H2O(g) ΔH2
①上述反应符合“原子经济”原则的是 (填“I”或“Ⅱ”)。
②下表所列数据是反应I在不同温度下的化学平衡常数(K)。
| 温度 |
250℃ |
300℃ |
350℃ |
| K |
2.041 |
0.270 |
0.012 |
由表中数据判断ΔH1 0(填“>”、“=”或“<”)。
③某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2mol/L,则CO的转化率为 。
(2)某实验小组依据甲醇燃烧的反应原理,设计如图所示的电池装置。
① 该电池正极的电极反应为 。
②工作一段时间后,测得溶液的pH减小,该电池总反应的离子方程式为 。
由短周期元素组成的单质A、B、C和甲、乙、丙、丁四种化合物有图示的转换关系, 已知C为密度最小的气体。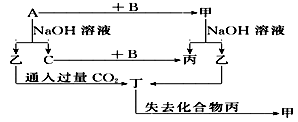
根据图示转化关系回答:
(1)若甲是电解质?写出下列物质的化学式:甲________,乙________,丁________?
写出乙与过量CO2反应的离子方程式_______________________?
(2)若甲是非电解质?写出下列物质的化学式:甲________,乙________,丁________?
(8分)类推法是科学学习的重要方法之一。在学习了卤族元素的各种性质后,如下表所示,表格提供的是氧族元素的部分性质。请结合元素周期律完成下列问题:
| 元素 |
8O |
16S |
34Se |
52Te |
| 单质熔点(℃) |
-218.4 |
113 |
450 |
|
| 单质沸点(℃) |
-183 |
444.6 |
685 |
1390 |
| 主要化合价 |
-2 |
-2,+4,+6 |
-2,+4,+6 |
|
| 原子半径 |
逐渐增大 |
|||
| 单质与H2反应情况 |
点燃时易化合 |
加热化合 |
加热难化合 |
不能直接化合 |
(1)硒的熔点范围可能是。
(2)碲的化合价可能有。
(3)氢硒酸有较强的还原性。因此放在空气中长期保存易变质,其可能发生的化学方程式为:
。
(4)工业上Al2Te3可用来制备H2Te,完成下列化学方程式:
Al2Te3+→Al(OH)3↓+ H2Te↑
有X、Y、Z三种元素,其中Y、Z为短周期元素,;X元素在周期表的第五周期,X的负价阴离子的原子核外电子排布与氙的原子核外电子排布相同;Z和X的原子最外层电子数相等;Y有两种氧化物,其水溶液都呈碱性,其氧化物的摩尔质量分别是62g/mol和78g/mol。在X和Y化合生成物的水溶液中滴入淡黄绿色的Z单质的水溶液,溶液由无色变成深黄色。试回答:
(1)元素符号:X________,Y_________,Z__________。
(2)Y的两种氧化物为____________和___________。
写出此两种氧化物与水反应的化学方程式_____________;____________。
(3)Z的单质溶于水,滴加到X和Y形成的化合物的水溶液中,可发生反应,该反应的离子方程式为___________________。
(4)写出Y和Z形成的化合物的电子式:___________;Z单质分子的电子式:__________
如下图所示,将铁、铜通过导线相连,置于稀硫酸中。
(1)铁片上的现象是,电极反应式。
(2)铜片上的现象是,电极反应式。
(3)写出该电池总反应的离子方程式。
在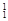 H,
H,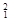 H,
H,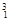 H,
H,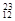 Mg,
Mg,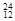 Mg,
Mg,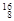 O,
O,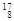 O,
O,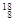 O中共有______种元素,______种原子,中子数最多的是。D218O的相对分子质量是______。
O中共有______种元素,______种原子,中子数最多的是。D218O的相对分子质量是______。