雄黄(As4S4)和雌黄(As2S3)是提取砷的主要矿物原料,二者在自然界中共生。
根据题意完成下列填空:
(1)As2S3和SnCl2在盐酸中反应转化为As4S4和SnCl4并放出H2S气体。若As2S3和SnCl2正好完全反应,As2S3和SnCl2的物质的量之比为_______。
(2)上述反应中的氧化剂是_______,反应产生的气体可用_______吸收。
(3)As2S3和HNO3有如下反应:As2S3 + 10H+ + 10NO3-→2H3AsO4 + 3S+ 10NO2↑+ 2H2O
若生成2mol H3AsO4,则反应中转移电子的物质的量为_______。若将该反应设计成原电池,则NO2应该在____(填“正极”或“负极”)附近逸出。
(4)若反应产物NO2与11.2L O2(标准状况)混合后用水吸收全部转化成浓HNO3,然后与过量的碳反应,所产生的CO2的量____(选填编号)。
a.小于0.5 mol b.等于0.5 mol c.大于0.5 mol d.无法确定
(本题共14分)
A~J分别表示中学化学中常见的一种物质,它们之间相互关系如下图所示(部分反应物、生成物没有列出),且已知G为主族元素的固态氧化物,A、B、C、D、E、F六种物质中均含同一种元素。请填写下列空白:
(1)A、B、C、D、E、F六种物质中的含有同一种元素在周期表中位置,
(2)写出检验D溶液中阳离子的方法。
(3)写出反应④的离子方程式。
(4)若28gA单质在足量的氧气中灼烧,反应放出的热量为QkJ(Q>0),写出这个反应的热化学方程式:;
(5)若向气体K的水溶液中加入盐酸,使其恰好完全反应,所得溶液的pH7
(填“>”、“<”或“=”),用离子方程式表示其原因:;若向气体K的0.1mol/L水溶液中加入pH=1的硫酸,且氨水与硫酸的体积比为1:1,则所得溶液中含各离子物质的质量浓度由大到小的关系是。
(本题共12分)
以海水中常见物质A为原料可以发展很多种工业,下图中包含了中学课本中介绍的几种基本工业生产,请根据物质之间的转化关系回答下列问题:
(1)C和D、C和G反应都可以制取消毒剂。C和G反应制取的消毒剂中有效成分的化学式为;
(2)写出电解A溶液的化学方程式为;
(3)若使工业合成J反应的平衡向生成J的方向移动,可采取的措施有(填字母代号);
A.升高温度 B.增大压强 C.使用催化剂 D.液化分离
(4)将F和J通入A的饱合溶液中的顺序为。
A.先通入F后通入J B.先通入J后通入F
C.同时通入 D.没有先后顺序要求
(5)图中所示工业制法获得的纯碱中常含有NaCl杂质,用下述方法可以测定样品中
NaCl的质量分数。

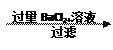
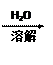
样品mg溶液沉淀固体ng
①检验沉淀是否洗涤干净的所用到的试剂是:,
②样品中NaCl的质量分数的数学表达式为:。
【化学-有机化学基础】菠萝酯(结构简式如下)是一种具有菠萝香气的食用香料,
其的合成路线如下:
提示:
(1)有机物乙中所含有的官能团是_________
(2)上述合成菠萝酯的过程中,下列反应类型中未涉及到的是___________。
| A.取代反应 | B.加成反应 | C.消去反应 | D.中和反应 |
(3)菠萝酯有多种同分异构体,写出同时满足下列三个条件的同分异构体的结构简式。(写出其中的一种即可)
①能使溴的四氯化碳溶液褪色,遇FeCl3溶液不显紫色
②除苯环外无其他环状基团
③能与NaOH溶液反应,且1mol该同分异构体最多能与2molNaOH反应
_____________________________________________________________________
(4)写出由丙→菠萝酯的化学化学方程式。______________________________________。
(本题共14分)
A~J分别表示中学化学中常见的一种物质,它们之间相互关系如下图所示(部分反应物、生成物没有列出),且已知G为主族元素的固态氧化物,A、B、C、D、E、F六种物质中均含同一种元素。请填写下列空白: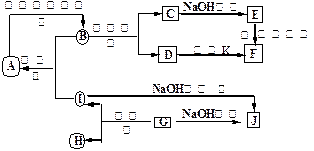
(1)A、B、C、D、E、F六种物质中的含有同一种元素在周期表中位置 ,
(2)写出检验D溶液中阳离子的方法 。
(3)写出反应④的离子方程式 。
(4)若28gA单质在足量的氧气中灼烧,反应放出的热量为QkJ(Q>0),写出这个反应的热化学方程式: ;
(5)若向气体K的水溶液中加入盐酸,使其恰好完全反应,所得溶液的pH 7
(填“>”、“<”或“=”),用离子方程式表示其原因: ;若向气体K的0.1mol/L水溶液中加入pH=1的硫酸,且氨水与硫酸的体积比为1:1,则所得溶液中含各离子物质的质量浓度由大到小的关系是 。
(本题共12分)
以海水中常见物质A为原料可以发展很多种工业,下图中包含了中学课本中介绍的几种基本工业生产,请根据物质之间的转化关系回答下列问题: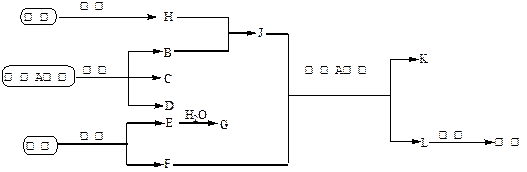
(1)C和D、C和G反应都可以制取消毒剂。C和G反应制取的消毒剂中有效成分的化学式为 ;
(2)写出电解A溶液的化学方程式为 ;
(3)若使工业合成J反应的平衡向生成J的方向移动,可采取的措施有 (填字母代号);
A.升高温度 B.增大压强 C.使用催化剂 D.液化分离
(4)将F和J通入A的饱合溶液中的顺序为 。
A.先通入F后通入J B.先通入J后通入F
C.同时通入 D.没有先后顺序要求
(5)图中所示工业制法获得的纯碱中常含有NaCl杂质,用下述方法可以测定样品中
NaCl的质量分数。

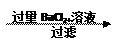

样品mg溶液沉淀固体ng
①检验沉淀是否洗涤干净的所用到的试剂是: ,
②样品中NaCl的质量分数的数学表达式为: 。