目前电解法制烧碱通常采用离子交换膜法,阳(阴)离子交换膜不允许阴(阳)
离子通过。则以下叙述错误的是( )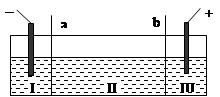
| A.NaOH、H2均在Ⅰ区产生 |
| B.图中a为阴离子交换膜 |
| C.Ⅲ区炭棒上的电极反应式为2Cl--2e →Cl2↑ |
| D.电解时往Ⅲ区的溶液中滴加甲基橙,溶液先变红后褪色 |
“垃圾是放错了位置的资源”,应该分类回收利用。生活中废弃的塑粒袋、医院的废输液管、废旧轮胎等可以归为一类加以回收利用。它们属于()
| A.糖类 | B.有机物 | C.氧化物 | D.盐 |
ClO2是新一代饮用水的消毒剂,许多发达国家的自来水厂采用ClO2代替CL2来进行自来水消毒。我国最近成功研制出制取CLO2的新方法,其反应的微观过程如下所示: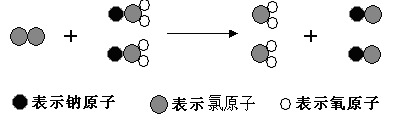
下列有关该反应的叙述中正确的是
| A.该反应是复分解反应 |
| B.该反应的化学方程式为Cl2+2NaClO2====2ClO2+2NaCl |
| C.反应中Cl2既是氧化剂,又是还原剂 |
| D.NaClO2和ClO2中Cl的化合价相同 |
饱和氯水长期放置后,下列微粒在溶液中不减少的是
| A.Cl2 | B.HClO | C.Cl- | D.H2O |
为了除去氯气中混有的少量水蒸气,可使含杂质的氯气通过某特定的干燥管,此干燥管中装有下列药品中的.
| A.五氧化二磷粉未 | B.浓硫酸 | C.饱和食盐水 | D.碱石灰 |
浓盐酸与次氯酸钙能发生如下反应:
Ca(ClO)2+4HCl(浓)=CaCl2+2Cl2↑+2H2O,用贮存较久的漂白粉与浓盐酸反应制得的氯气中,可能含有的杂质气体是①CO2② HCl ③水蒸气 ④O2中的
| A.①②③ | B.②③④ | C.②③ | D.①③ |