(本题共10分)
硫化钠是用于皮革鞣制的重要化学试剂,可用无水芒硝(Na2SO4)与炭粉在高温下反应而制得,反应式如下:Na2SO4+ 4C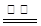 Na2S+4CO↑ ② Na2SO4+4CO
Na2S+4CO↑ ② Na2SO4+4CO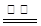 Na2S+4CO2
Na2S+4CO2
(1)现要制取Na2S 7.80 g,若生产过程中无水芒硝(Na2SO4)的利用率为90%,则理论上需要无水芒硝(Na2SO4) g(精确到0.01);
(2)若在反应中生成的Na2S物质的量为1 mol,则消耗的碳单质的物质的量n的范围是
≤ n ≤ ;
(3)若在上述反应中消耗的碳单质为1 mol,生成Na2S的物质的量为y mol,生成的CO和CO2的物质的量之比为x,则y与x的关系式为y= ;
(4)Na2S放置在空气中,会被缓慢氧化成Na2SO3及Na2SO4,现称取已经部分氧化的硫化钠样品39.20 g溶于水中,加入足量盐酸,充分反应后过滤得沉淀9.6 g,放出H2S气体1.12 L(标准状况)。请计算:39.20 g样品中各氧化产物的物质的量(不考虑气体在水中的溶解)。
有硫酸与硝酸的混合液,取出其中10ml,加入足量的BaCl2溶液,将生成的沉淀过滤洗涤,干燥称得质量为9.32g.另取这种溶液10ml与4mol/L的NaOH溶液25ml恰好中和。求混合液中H2SO4与HNO3的物质的量浓度是多少?
另取10ml的混合液与0.96g铜粉共热时,有多少ml气体产生?
有一瓶白色固体,取少量置于试管中加热,固体逐渐消失,放出水蒸气和其他两种气体,试管内除管口有少量水珠外,没有任何残留物。取0.350g这种固体跟过量的碱液反应,生成一种能使湿润红色石蕊试纸变蓝的气体,这些气体正好能和30.0mL、0.100mol/L H2SO4完全反应;另取0.350g该固体跟足量的盐酸反应,放出一种无色、无溴的气体,将这些气体通入过量的澄清石灰水中,得到0.400g白色沉淀。计算0.350g固体中含有的阴离子和阳离子的物质的量。
根据实验及计算结果确定白色固体是什么?写出判断依据。
(6分)在隔绝空气的条件下,某同学将一块被氧化钠覆盖的钠块用一张无保护膜并用针刺一些小孔的铝箔包好,然后放入盛满水且倒置于水槽中的容器内。待反应完全后,在容器中收集到1.12L氢气(标准状况),此时测得铝箔质量比反应前减少了0.27g,水槽和容器内溶液的总体积为2.0L,溶液中NaOH的浓度为0.050mol·L-1(忽略溶解的氢气的量)。试通过计算确定该钠块中钠元素的质量分数。
(4分)将一定质量铜与100 mL一定浓度的硝酸反应,铜完全溶解时产生的NO和NO2混合气体在标准状况下的体积为11.2 L。待产生的气体全部释放后,向溶液加入140mL 5 mol·L-1的NaOH溶液,恰好使溶液中的Cu2+ 全部转化成沉淀,求原硝酸溶液的物质的量浓度是多少。
(8分) Fe是人体不可缺少的微量元素,摄入含铁化合物可补充铁。
⑴正常人每天应补充14mg左右的铁。其中绝大部分来自于食物。如果全部通过服用含FeSO4·7H2O的片剂来补充铁,则正常人每天服需用含mg FeSO4·7H2O的片剂。
⑵“速力菲”是市场上一种常见的补铁药物,其中Fe2+的含量为35.0%。该药品中Fe2+会缓慢氧化。国家规定该药物中Fe2+的氧化率超过10%即不能再服用。为检验某药店出售的“速力菲”是否失效,取10.00g该药品全部溶于稀硫酸,配制成1000mL溶液。取其中20.00mL,用0.01000 mol/L KMnO4溶液滴定,用去KMnO4溶液24.00mL。通过计算说明该药物是否能服用?(MnO4-在酸性条件下的还原产物为Mn2+,药品中除Fe元素外其他成分不与KMnO4反应)