四种短周期元素W、X、Y、Z,其原子的最外层电子数之和为19,W和X元素原子核的质子数之比为1∶2, Y的核外电子数比X多4,Z的核电荷数大于X。下列说法正确的是
| A.原子半径大小:Z>Y>X>W |
| B.由W元素形成的单质一定是原子晶体,其熔沸点很高 |
| C.W、Y、Z三种元素形成的气态氢化物中最稳定的是Z的气态氢化物 |
| D.Y、Z所形成的氧化物的水化物的酸性为:Y<Z |
在恒温恒容条件下,向容积为2L的密闭容器中充入2.0molSO2和2.0molO2。已知:2SO2(g)+O2(g) 2SO3(g) ∆H=-akJ/mol(a>0),经2min达到平衡状态,反应放热0.25akJ。下列判断正确的是
2SO3(g) ∆H=-akJ/mol(a>0),经2min达到平衡状态,反应放热0.25akJ。下列判断正确的是
| A.在1min时:c(SO3)+c(SO2)="1.0" mol·L-1 |
| B.在2min内:v(SO2)="0.25" mol·L-1·min-1 |
| C.若再充入2molSO3,达到平衡时SO3的质量分数减小 |
| D.反应条件相同,若起始时向反应容器充入2molSO3,达到平衡时反应吸热0.75 akJ |
把足量熟石灰放入蒸馏水中,一段时间后达到平衡:
Ca(OH)2(s)  Ca2+(aq)+2OH-(aq),下列叙述正确的是
Ca2+(aq)+2OH-(aq),下列叙述正确的是
| A.给溶液加热,溶液的pH升高 |
| B.恒温下向溶液中加入CaO,溶液的pH升高 |
| C.向溶液中加入Na2CO3溶液,则其中的Ca(OH)2的固体增多 |
| D.向溶液中加入少量的NaOH固体,则其中的Ca(OH)2的固体增多 |
草酸是二元弱酸,草酸氢钾溶液呈酸性。在0.1mol·L-1KHC2O4溶液中,下列关系正确的是
| A.c(K+)+ c(H+)= c(HC2O4-)+ c(OH-)+ c(C2O42-) |
| B.c(HC2O4-)+ c(C2O42-)=" 0.1" mol·L-1 |
| C.c(H2C2O4)>c(C2O42-) |
| D.c(K+)= c(H2C2O4)+ c(HC2O4-)+ c(C2O42-) |
常温下,下列有关叙述正确的是
| A.Na2CO3溶液中,2c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) |
| B.NaB溶液的pH=8,c(Na+)-c(B-)=9.9×10-7mol/L |
| C.pH相等的①NH4Cl ②(NH4)2SO4 ③NH4HSO4溶液中,c(NH4+)大小顺序①>②>③ |
| D.10mL pH=12的氢氧化钠溶液中加入pH=2的HA至pH=7,所得溶液体积V(总)≥20mL |
常温下,用 0.1000 mol·L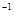 NaOH溶液滴定 20.00mL0.1000 mol·L
NaOH溶液滴定 20.00mL0.1000 mol·L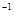
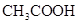 溶液所得滴定曲线如下图。下列说法正确的是
溶液所得滴定曲线如下图。下列说法正确的是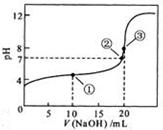
A.点①所示溶液中: |
B.点②所示溶液中: |
C.点③所示溶液中: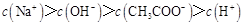 |
D.滴定过程中可能出现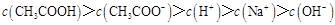 |