下列说法正确的是
| A.在由水电离产生的氢离子浓度为10-13 mol•L-1的溶液中:Ca2+、K+、Cl-、HCO3-四种离子能大量共存 |
| B.已知MgCO3的Ksp=6.82×10-6,则所有含有固体MgCO3的溶液中,都有c(Mg2+)=c(CO32-) ,且c(Mg2+)∙c(CO32-)=6.82×10-6 |
| C.对于反应2N2H4(l)=N2(g)+2H2(g),△H=-50.6 kJ∙mol-1,它只在高温下自发进行 |
| D.常温下,将0.2 mol∙L-1某一元碱(ROH)溶液和0.1 mol∙L-1HCl溶液等体积混合,混合后溶液pH<7,则c(ROH)>c(R+) |
铝热反应(如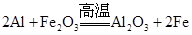 )中,铝的作用是( )
)中,铝的作用是( )
| A.还原剂 | B.氧化剂 | C.催化剂 | D.干燥剂 |
下列物质属于单质的是( )
| A.石墨 | B.赤铁矿 | C.青铜 | D.碳素墨水 |
下列基本反应类型中,一定有单质生成的是( )
| A.化合反应 | B.分解反应 | C.置换反应 | D.复分解反应 |
下列关于金属钠的叙述中,说法正确的是( )
| A.钠在空气中燃烧,产物是Na2O | B.钠是银白色金属,硬度大,熔点高 |
| C.钠投入氯化铁溶液中出现红褐色沉淀 | D.钠与水反应生成O2 |
下列说法正确的是( )
| A.金属钠应保存在水里以隔绝空气 |
| B.常温下铁能与水蒸气反应生成氢气 |
| C.可以用铁制品或铝制品容器盛放浓H2SO4 |
| D.铝较活泼,所以铝制品在空气中不能稳定存在 |