A、B、C、D、E五种物质是由常见元素组成,A由两种元素组成,且A中两种元素的质量比为7∶8。A和B在高温条件下反应生成C和D,C为无色气体,在标准状况下的密度约为2.86g∙L-1。以A为原料生产E。
⑴写出A的化学式:
⑵A和B的反应中,还原剂与氧化剂的物质的量之比为 ,
⑶某人设想用右图所示装置利用电化学原理生产E,则N电极是 极;写出M电极的电极反应式: 。
⑷当图中的C与O2被活性炭吸附时,也能发生反应生成F,为研究此反应,将C和O2放入体积为2L的恒容密闭容器中,在500℃时发生反应,反应过程中的能量变化如下图所示,反应物物质的量和时间的变化如下表所示:
①该反应的ΔH 0反应从起始至2min内的平均反应速率v(C)= ;
500℃时,此反应化学平衡常数K的值为 。
②第6min时,向容器中再充入0.002molO2,同时将反应体系的温度改变为T,反应至10min时重新达到平衡,此时测得c(C)=0.006mol∙L-1,则温度T (填“>”或“<”)500℃。
实验室也可用KMnO4固体和浓盐酸反应制氯气,反应方程式如下:
2KMnO4+16HCl(浓)=2KCl+2MnCl2+8H2O+5Cl2↑
完成下列问题:
(1)该反应中氧化剂是,还原剂是,氧化产物是,还原产物是。
(2)用双线桥标出该反应的电子得失的方向和数目。
氢气、甲烷(CH4)、水各1g,其中含分子数最多的是;含氢原子最多的是;氢气、甲烷、水各1mol,含分子数是否一样多?(填“是”或“不是);含氢原子数最多的是。
今有九种物质:①铝②石墨③氯气④BaSO4晶体⑤纯硫酸⑥金刚石⑦石灰水⑧乙醇⑨熔化的KNO3(填序号)
其中能导电的是,属于电解质的是,既不是电解质,也不是非电解质的是。
根据下列微粒的结构示意图,写出相应的原子或离子符号: ,
,
已知2A(g)+B(g) 2C(g),向容积为1L的密闭容器中加入0.050mol A和0.025mol B,在500℃时充分反应,达平衡后测得
2C(g),向容积为1L的密闭容器中加入0.050mol A和0.025mol B,在500℃时充分反应,达平衡后测得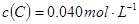 ,放出热量Q1 kJ。
,放出热量Q1 kJ。
(1)能说明上述反应已经达到化学平衡状态的是______________(填字母编号)
a.v(C)=2v(B)b.单位时间内生成2mol A的同时消耗1molB
c.容器内压强保持不变 d.容器内气体的密度保持不变
(2)若在相同的容器中只加入0.050mol C,500℃时充分反应达平衡后,吸收热量Q2 kJ,则Q1与Q2之间的关系式可表示为___________________________(用含Q1、Q2的代数式表示)。
(3)500℃时,上述反应的化学平衡常数K=____________________。
(4)已知K(300℃)>K(350℃),该反应是__________(填“放”或“吸”)热反应;若反应温度升高,A的转化率___________________(填“增大”、“减小”或“不变”)。
(5)某温度下,A的平衡转化率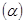 与体系总压强(P)的关系如图所示,平衡状态由a变到b时,化学平衡常数K(A)______________K(B)(填“>”、“<”或“=”)
与体系总压强(P)的关系如图所示,平衡状态由a变到b时,化学平衡常数K(A)______________K(B)(填“>”、“<”或“=”)