(1)家用液化气的主要成分之一是丁烷(C4H10),当1 kg丁烷完全燃烧生成二氧化碳和液态水时,放出热量为5×104kJ,试写出表示丁烷燃烧热的热化学方程式:
(2)已知:C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ·mol-1
2H2(g)+O2(g)=2H2O(g) ΔH=-483.6 kJ·mol-1
现有0.2 mol的炭粉和氢气组成的悬浮气,且混合物在氧气中完全燃烧,共放出63.53 kJ热量,则混合物中C与H2的物质的量之比为
(3)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列3个热化学反应方程式:
Fe2O3(s)+3CO(g)="=" 2Fe(s)+3CO2(g) △H=—24.8 kJ·mol-1
3Fe2O3(s)+ CO(g)==2Fe3O4(s)+ CO2(g) △H=—47.4 kJ·mol-1
Fe3O4(s)+CO(g)==3FeO(s)+CO2(g) △H= +640.5 kJ·mol-1
写出CO(g)还原FeO(s)得到Fe (s)体和CO2(g)的热化学反应方程式:
苯酚是重要的化工原料,通过下列流程可合成阿司匹林、香料和一些高分子化合物。已知: 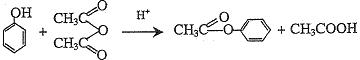
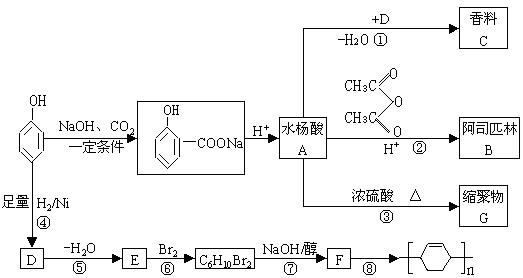
(1)写出C的结构简式。
(2)写出反应②的化学方程式。
(3)写出G的结构简式。
(4)写出反应⑧的化学方程式。
(5)写出反应类型:④⑦。
(6)下列可检验阿司匹林样品中混有水杨酸的试剂是。
(a)三氯化铁溶液 (b)碳酸氢钠溶液 (c)石蕊试液
甲醇被称为2l世纪的新型燃料,工业上通过下列反应Ⅰ和Ⅱ,用CH4和H2O为原料来制备甲醇。
(1)将1.0 mol CH4和2.0 mol H2O(g)通入反应室(容积为100L),在一定条件下发生反应:
CH4(g)+H2O(g) CO(g)+3H2(g)……Ⅰ,CH4的转化率与温度、压强的关系如右图。
CO(g)+3H2(g)……Ⅰ,CH4的转化率与温度、压强的关系如右图。
已知100℃时达到平衡所需的时间为5min,
①则用H2表示的平均反应速率为_。
②图中的P1_ _P2(填“<”、“>”或“=”),100℃时平衡常数为_ _。
_。
③在其它条件不变时降低温度,逆反应速率将_ _(填“增大”“减小”或“不变”)。
(2)在压强为0.1 MPa条件下, 将a mol CO与 3amol H2的混合气体在催化剂作用下能自发反应生成甲醇:CO(g)+2H2(g) CH3OH(g)……Ⅱ。
CH3OH(g)……Ⅱ。
④该反应的 △H_ _0,△S_ _0(填“<”、“>”或“=”)。
△H_ _0,△S_ _0(填“<”、“>”或“=”)。
⑤若容器容积不变,下列措施可增加甲醇产率的是_ _。
A.升高温度
B.将CH3OH(g)从体系中分离出来
C.充入He,使体系总压强增大
D.再充入1mol CO和3mol H2
⑥为了寻找合成甲醇的温度和压强的适宜条件,某同学设计了三组实验,部分实验条件已经填在下面实验设计的表中。
| l实验编号 |
lT(℃) |
ln (CO)/n(H2) |
lP(MPa) |
| lⅰ |
l150 |
l1/3 |
l0.1 |
| lⅱ |
l_ _ |
l_ _ |
l5 |
| lⅲ |
l350 |
l_ _ |
l5 |

A.请在上表空格中填入剩余的实验条件数据。
B.根据反应Ⅱ的特点,在给出的坐标图中,画出其在0.1MPa和5MPa条件下CO的转化率随温度变化的趋势曲线示意图,并标明各条曲线的压强。
中学化学中几种常见物质的转化关系如图19所示,且已知将F的饱和溶液滴入沸水中,煮沸可得到以H为分散质的红褐色胶体。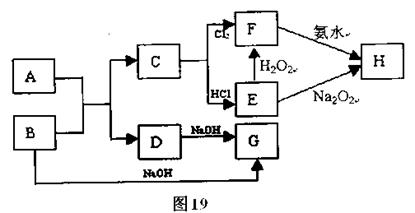
请回答下列问题:
(1)红褐色胶体中H粒子的直径大小范围。
(2)写出D、E的化学式:D、E
(3)①写出H2O2的电子式:
②写出E的酸性溶液与双氧水反应的离子方程式。
(4)写出检验F中阳离子的实验操作、现象及有关反应的离子方程式。
实验操作;
现象,离子方程式。
(5)在E溶液中加入与E等物质的量的Na2O2能恰好使E转化为H,写出该反应的化
学方程式。
(本题14分)工业上用CO生产燃料甲醇。一定条件下发生反应: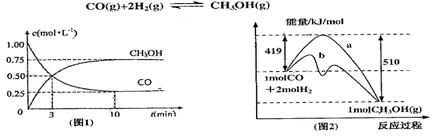
(1)图l是反应时CO和CH3OH(g)的浓度随时问变化情况。从反应开始到平衡,用CO浓度变化表示平均反应速率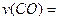 ;
;
(2)图2表示该反应进行过程中能量的变化。曲线a表示不使用催化剂时反应的能量变化,曲线b表使用催化剂后的能量变化。该反应的焓变是(选填“△H<0”或“ H>0”)反应,写出反应的热化学方程式;选择适宜的催化剂,(填“能”或“不能”)改变该反应的反应热;
H>0”)反应,写出反应的热化学方程式;选择适宜的催化剂,(填“能”或“不能”)改变该反应的反应热;
(3)该反应平衡常数K的表 达式为,温度升高,平衡常数K(填“增大”、“不变”或“减小”);
达式为,温度升高,平衡常数K(填“增大”、“不变”或“减小”);
(4)恒容条件下,下列措施中能使 增大的。
增大的。
a.升高温度; b.充入He气
c.再充入1molCO和2mol H2 d.使用催化剂
K2EO4(E代表某种元素)是一种不常见的含氧酸盐,但在工业上有重要的应用,以下是制备该物质的工艺流程图: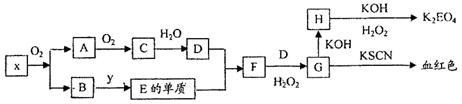
已知:A和C是由同一主族元素组成的化合物,x是工业上制D的重要原料。
请回答以下问题:
(1)x的化学式是,H的化学式是。
(2)写出F→G的离子反应方程式
(3)要实现B→E的转化,y的化学式可能是
(4)H→K2EO4过程中H2O2的作用,lmol H转化为K2EO4时需H2O2的物质的量是。