氯气是一种重要的化工原料,在生产和生活中应用十分广泛。
已知: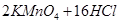 (浓)="==="
(浓)="===" 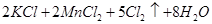 ,
,
在实验室可用二氧化锰固体或高锰酸钾固体和浓盐酸反应制取氯气。可供选用的发生装置如下图。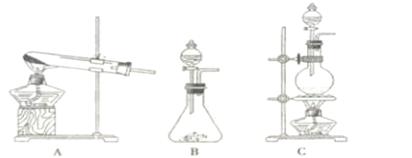
(1)若用高锰酸钾固体和浓盐酸反应制取氯气,发生装置是 。(选填A或B或c)
(2)写出用二氧化锰固体和浓盐酸反应制取氯气的化学方程式: 。
(3)实验室收集氯气的方法是 。
(4)常用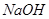 溶液吸收氯气防止污染。写出该反应的离子方程式 。
溶液吸收氯气防止污染。写出该反应的离子方程式 。
有短周期元素A、B、C、D、E,已知:
①常温下,A元素的单质在空气或浓硫酸中,表面都能生成致密的氧化膜 ② B元素的原子序数比A元素大,其原子的次外层的电子数是最外层电子数的2倍
② B元素的原子序数比A元素大,其原子的次外层的电子数是最外层电子数的2倍
③ E与A同周期,C、D、E三种元素形成的单质或化合物可发生如下图所示的反应。
请用化学式或相应的符号回答下列问题:
(1)写出A元素最高价氧化物与NaOH溶液反应的离子方程式;
(2)B元素在元素周期表第周期第族;
B的固态氧化物的晶体类型是;
(3)D元素的原子结构示意图是:;
(4)B元素与E元素的最高价氧化物的水化物的酸性强弱>;
(5)请用化学方程式表示E元素的单质在工业上的一种重要用途:。
某化学兴趣小组参考工业制硝酸的化学原理,在实验室用下列各装置进行组合来制备硝酸并验证硝酸的性质(所给装置必须用到并且只能用一次,各装置中的试剂均足量。已知常温下CaCl2能吸收氨气)。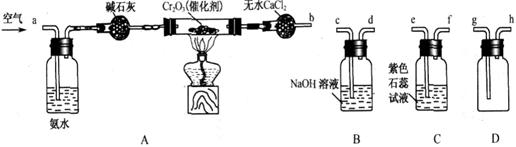
(1)装置的连接顺序为(用a、b、c、d等字母表示):b接( ),( )接( ),( )接( )。
(2)写出氨气催化氧化的化学方程式______________________。
(3)进行实验时,装置A中碱石灰的作用是_____________;D中的现象是_______________。
(4)能证明有硝酸生成的现象是__________________________________________。
(5)实验开始时,下列操作顺序最合理的是______________。
a.先加热A装置中的催化剂.再由导管a通入空气
b.先由导管a通人空气,再加热A装置中的催化剂
c.在由导管a通人空气的同时,加热A装置中的催化剂
下图所示装置为铜跟浓硫酸反应制取二氧化硫的实验装置:请回答下列问题: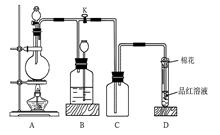
(1)在装置A中放入有关药品后,打开活塞K,将分液漏斗中的液体加入烧瓶中,关闭分液漏斗的活塞,点燃酒精灯,烧瓶中反应的化学方程式为__________。
(2)装置D中试管口放置的棉花中应浸有一种液体,这种液体是________,其作用是_________________。
(3)装置B的作用是贮存多余的二氧化硫和防止其污染环境,则B中应盛放的液体是(填写字母代号)________;
a.水 b.浓溴水;c.KMnO4酸性溶液d.NaHSO3饱和溶液
(4)收集二氧化硫完毕,应进行的操作为:________________________________。
(5)若用该套的A、B、C装置制备H2S,则B中应加入的最合理的液体是____________。
实验室欲配制80mL 1.4mol/L的NaNO3溶液,试回答:
(1)用不到的仪器是:;
A.烧杯 B.500mL容量瓶 C.量筒 D.胶头滴管 E.玻璃棒 F.100mL容量瓶
(2)配制时应称取NaNO3g;
(3)下列操作的顺序是(用字母表示);
A.冷却 B.称量 C.洗涤 D.定容 E.溶解 F.摇匀 G.转移
(4)在配制一定物质的量浓度溶液的实验中,下列操作对所配得溶液无影响的是(写序号);会使所配溶液的浓度偏大的是。
A.在烧杯中溶解溶质,搅拌时不慎溅出少量溶液;
B.未将洗涤烧杯内壁的溶液转移入容量瓶;
C.容量瓶中所配的溶液液面未到刻度线便停止加水;
D.将配得的溶液从容量瓶转移到干燥、洁净的试剂瓶中时,有少量溅出;
E.将烧杯中溶液转移到容量瓶之前,容量瓶中有少量蒸馏水;
F.将容量瓶中液面将达到刻度线时,俯视刻度线和液面。
鸡蛋壳中含有大量钙、少量镁和钾等元素。实验室可用图示流程测定鸡蛋壳中钙、镁元素含量。依据的反应可以表示为:Ca2++Y2-=CaY、Mg2++Y2-=MgY。回答下列问题。
(1)测定Ca2+、Mg2+总含量时,控制溶液pH=10。若pH过大,测定结果将(填“偏大”、“偏小”或“无影响”)。
(2)如果鸡蛋壳粉质量为m g,溶液中Y2+浓度为c mol/L,则鸡蛋壳样品中镁元素质量分数是。
(3)有同学提出可采用如下装置,通过测定鸡蛋壳与盐酸反应产生的二氧化碳的量就能测定鸡蛋壳中的钙的总含量。
①采用该方法进行实验,各装置从左到右的连接顺序依次1→2→____________(填各装置对应接口的数字序号)。
②若排除实验仪器和操作的影响因素,此实验方法测得的结果是否准确?答:________(填“准确”、“不准确”或“无法判断”)。原因是。