已知H—H键能为436 KJ/mol,H—N键能为391kJ/mol,根据化学方程式:N2(g)+ 3H2(g)= 2NH3(g)ΔH="—92.4" kJ/mol,则N≡N键的键能是()
| A.431 kJ/mol | B.946 kJ/mol | C.649 kJ/mol | D.869 kJ/mol |
常温下,将0.02 mol·L-1的Ba(OH)2溶液100mL和0.02 mol·L-1NaHSO4溶液100mL混合,若忽略溶液体积变化,则混合后的溶液
| A.pH=12 | B.溶质的物质的量浓度=0.02 mol·L-1 |
| C.pH=2 | D.由水电离的产生的c(H+)=1.0×10-2 mol·L-1 |
电导率是衡量电解质溶液导电能力大小的物理量,根据溶液电导率变化可以确定滴定反应的终点。右图是KOH溶液分别滴定HCl溶液和CH3COOH溶液的滴定曲线示意图。下列示意图中,能正确表示用NH3·H2O溶液滴定HCl和CH3COOH混合溶液的滴定曲线的是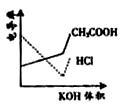
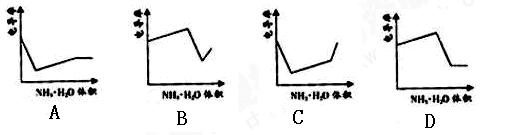
下列说法正确的是
| A.pH=5的盐酸,再加水冲稀1000倍,溶液的pH=8 |
| B.给稀醋酸溶液适当加热,溶液pH值增大 |
| C.pH=1的盐酸中c(H+)是pH=3的盐酸的100倍 |
| D.在Na2CO3溶液中,C(Na+) :C(CO32-)=2∶1 |
降低下列溶液的pH,而难溶电解质的溶解度保持不变的是
| A.Al(OH)3 | B.PbCl2 | C.Ag3PO4 | D.ZnCO3 |