合成高分子材料用途广泛、性能优异,其功能与分子结构有密切的关系。下面是几种高分子材料的结构简式: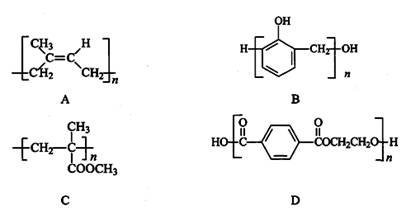
(1)A是天然橡胶的主要成分,易老化,A中含有的官能团的名称是____________。
(2)B的单体是苯酚和X,这两种单体在碱催化下,可得到网状高分子化合物,俗称电木,是(填“热塑性”或“热固性”)_________塑料,写出X与足量新制的Cu(OH)2悬浊液反应的化学方程式:
(3)C与NaOH溶液在一定条件下反应,生成高吸水性树脂,该树脂的结构简式是___________________________________。
(4)D是合成纤维中目前产量第一的聚酯纤维——涤纶,可由两种单体在一定条件下合成,则这两种单体的化学式是为___________________,______________________。
某有机物A的结构简式为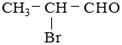 ,请回答下列问题。
,请回答下列问题。
(1)A中所含官能团的名称是、;
(2)A可能发生的反应有(填序号);
① 取代反应② 消去反应③ 水解反应④ 酯化反应
(3)将A与氢氧化钠的乙醇溶液混合并加热,再让得到的主要产物发生加聚反应,生成了某聚合物,该聚合物的结构简式是。
按要求回答下列问题。
(1)根据系统命名法,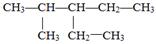 的名称是;
的名称是;
(2)羟基的电子式是;(3)顺-2-丁烯的结构简式是;
(4)相对分子质量为72且沸点最低的烷烃的结构简式;
(5)2,3-二甲基-2-戊烯的键线式;
(6)4,4,5-三甲基-2-己炔的结构简式.
工业上常用天然气作为制备甲醇 的原料。已知:
的原料。已知:
①



②



③



 与
与 反应生成
反应生成 的热化学方程式为。
的热化学方程式为。
(2)向VL恒容密闭容器中充入 与
与 ,在不同压强下合成甲醇。
,在不同压强下合成甲醇。 的平衡转化率与温度、压强的关系如下图所示:
的平衡转化率与温度、压强的关系如下图所示:
①压强
 (填“<”、“>”或“=”)
(填“<”、“>”或“=”)
②在 、
、 压强时,平衡常数为(用含
压强时,平衡常数为(用含 的代数式表示)。
的代数式表示)。
某同学模拟工业“折点加氯法”处理氨氮废水的原理,进行如下研究。
| 装置(气密性良好,试剂已添加) |
操作 |
现象 |
 |
打开分液漏斗活塞,逐滴加入浓氨水 |
ⅰ.C中气体颜色变浅 ⅱ.稍后,C中出现白烟并逐渐增多 |
(1)浓氨水分解可以制氨气,写出A中反应的化学方程式是。从平衡移动的角度分析NaOH固体在氨水分解中的作用。
(2)现象ⅰ,C中发生的反应为:2NH3(g)+3Cl2(g)= N2(g)+6HCl(g)H=—456 kJ·mol-1
已知:
①NH3的电子式是。
②断开1mol H-N键与断开1molH-Cl键所需能量相差约为,
(3)现象ⅱ中产生白烟的化学方程式是。
(4)为避免生成白烟,该学生设计了下图装置以完成Cl2和NH3的反应。
若该装置能实现设计目标,则①石墨b电极上发生的是反应(填“氧化”或“还原”)
②写出石墨a电极的电极反应式:。
(8分) CO2是最重要温室气体,如何降低大气中CO2的含量及有效地开发利用CO2具有重大意义。
(1)科学家用H2和CO2生产甲醇燃料。为探究该反应原理,进行如下实验:某温度下,在容积为2 L的密闭容器中充入1 mol CO2和3.25 mol H2,在一定条件下反应,测得CO2、CH3OH(g)和H2O(g)的物质的量(n)随时间的变化关系如图所示。
①写出该反应的化学方程式_______________________计算从反应开始到3 min时,氢气的平均反应速率v(H2)=____________________。
②下列措施中一定能使CO2的转化率增大的是___________________ 。
A在原容器中再充入1 mol H2B在原容器中再充入1 mol CO2
C缩小容器的容积D使用更有效的催化剂
E.在原容器中充入1 mol He F.将水蒸气从体系中分离出
(2)科学家还利用氢气在一定条件下与二氧化碳反应生成乙醇燃料,其热化学反应方程式为:2CO2(g)+6H2(g)  CH3CH2OH(g)+3H2O(g) ΔH=a kJ·mol-1,
CH3CH2OH(g)+3H2O(g) ΔH=a kJ·mol-1,
(3)在一定压强下,测得该反应的实验数据如表所示。请根据表中数据回答下列问题。
 温度(K) 温度(K) CO2转化率/(%) CO2转化率/(%)n(H2)/n(CO2) |
500 |
600 |
700 |
800 |
| 1.5 |
45 |
33 |
20 |
12 |
| 2 |
60 |
43 |
28 |
15 |
| 3 |
83 |
62 |
37 |
22 |
①上述反应的a________0(填“大于”或“小于”)。
②恒温下,向反应体系中加入固体催化剂,则该反应的反应热a值________(填“增大”、“减小”或“不变”)。
③在一定温度下,增大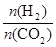 的值,CO2转化率_________,生成乙醇的物质的量________(填“增大”、“减小”、“不变”或“不能确定”)。
的值,CO2转化率_________,生成乙醇的物质的量________(填“增大”、“减小”、“不变”或“不能确定”)。