1-丁醇和乙酸在浓硫酸作用下,通过酯化反应制得乙酸丁酯,反应温度为115~125 ℃,反应装置如图。下列对该实验的描述错误的是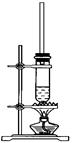
| A.不能用水浴加热 |
| B.长玻璃管起冷凝回流作用 |
| C.提纯乙酸丁酯需要经过水、氢氧化钠溶液洗涤 |
| D.加入过量乙酸可以提高1-丁醇的转化率 |
NA为阿伏伽德罗常数的值,下列叙述正确的是
| A.1.0L1.0mo1·L-1的NaAlO2水溶液中含有的氧原子数为2NA |
| B.28g乙烯和丙烯的混合物含有的碳原子数为2NA |
| C.25℃时pH=13的NaOH溶液中含有OH一的数目为0.1NA |
| D.1mol的羟基与1 mol的氢氧根离子所含电子数均为9NA |
下列化合物中同分异构体数目最少的是
| A.戊烷 | B.戊醇 | C.戊烯 | D.乙酸乙酯 |
下列说法正确的是
| A.用活性炭去除冰箱中的异味是发生了化学反应 |
| B.用热碱水清除炊具上残留的油污,是因为Na2CO3可直接和油污反应 |
| C.用浸泡过高锰酸钾溶液的硅藻土保存水果 |
| D.漂白粉在空气中久置变质是因为漂白粉中的CaCl2与空气中的CO2反应生成CaCO3 |
下列叙述错误的是
| A.常温下,将pH=11的氨水和pH=3的盐酸等体积混合后,所得溶液中各离子浓度的关系是c(NH4+)>c(Cl-)>c(OH-)>c(H+) |
| B.在BaSO4饱和溶液中加入少量的BaCl2溶液产生沉淀,平衡后的溶液中: (Ba2+)×c(SO42-)>Ksp(BaSO4);c(Ba2+)>c(SO42-) |
C.某二元酸的电离方程式为H2B=H++HB-,HB- H++B2-,所以NaHB溶液呈酸性 H++B2-,所以NaHB溶液呈酸性 |
| D.等浓度的NH4HSO4、NH4Cl、NH3.H2O溶液中c(NH4+)逐渐减小 |
我国知名企业比亚迪公司开发了具有多项专利的锂钒氧化物二次电池,其成本较低,对环境无污染,能量密度远远高于其他电池,电池总反应为V2O5 + xLi  LixV2O5。下列说法合理的是
LixV2O5。下列说法合理的是
| A.电池在放电时,Li+向负极移动 |
| B.锂在放电时作正极,充电时作阳极 |
| C.该电池充电时阳极的反应为LixV2O5 _ xe-=V2O5 + xLi+ |
| D.V2O5只是锂发生反应的载体,不参与电池反应 |