25 ℃时,浓度均为0.3 mol/L的Na2CO3和NaHCO3溶液中,下列判断不正确的是
| A.均存在电离平衡和水解平衡 |
| B.存在的粒子种类相同 |
| C.c(OH-)前者小于后者 |
| D.分别加入NaOH固体,恢复到原温度,c(CO32-)均增大 |
海洋中有丰富的食品、矿产,能源、药物和水产资源等(如下图所示):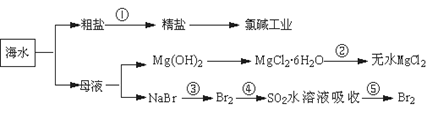
下列有关说法正确的是
| A.第①步中除去粗盐中的SO42—、Ca2+、Mg2+、Fe3+等杂质,加入的药品顺序为Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸 |
| B.第②步中结晶出的MgCl2·6H2O可在空气中受热分解制无水MgCl2 |
| C.在第③④⑤步中溴元素均被氧化 |
| D.从第③步到第⑤步的目的是为了浓缩 |
A、B是短周期第ⅦA族元素,元素A的非金属性比B强,下列说法正确的
A.NaA、NaB的晶体都是离子晶体
B.单质A可把B从NaB的溶液中置换出来
C.HA比HB沸点高的原因是1mol HA分子中H-A键断裂时吸收的能量比1mol HB分子中H-B键断裂时需要吸收的能量多
D.常温下,NaA、NaB溶液的pH均大于7
元素X、Y、Z原子序数之和为37,X、Y在同一周期,X+与Z-具有相同电子层结构。下列推测不正确的是
| A.同周期元素中X的金属性最强 |
| B.原子半径X>Y,离子半径X+>Z- |
| C.同族元素中Z的氢化物最稳定 |
| D.同周期元素中Y的最高价含氧酸的酸性最强 |
下列说法中正确的是
| A.元素的非金属性越强,其单质的活泼性一定越强 |
| B.原子晶体中原子以共价键结合,具有键能大、熔点高、硬度大的特性 |
| C.分子晶体的熔沸点低,常温下均呈液态或气态 |
| D.含有金属阳离子的晶体一定是离子晶体 |
下列有关物质的熔点的比较中,不正确的是
| A.晶体硅<金刚石 | B.K<Na | C.NaCl<NaBr | D.PH3<NH3 |