(14分)下表是元素周期表的前三周期,回答下列问题:
(1)可用于半导体材料的元素是 (填元素符号),它在元素周期表中的位置为 ;
(2)A、G两种元素分别与E元素都能形成两种化合物,其中属于离子化合物的是 (写化学式,下同),属于共价化合物的是 ;这四种化合物中含有非极性键的化合物是 。
(3)表格中十种元素的最高价氧化物对应的水化物中,碱性最强的是 ,属于两性氢氧化物的是 (用化学式表示);
(4)只含有A、C两种元素的化合物称做 ,这些化合物中相对分子质量最小的是 ,该化合物分子的空间构型是 ;
(5)画出元素H的原子结构示意图 ,元素H与元素J组成的化合物的水溶液中加入少量烧碱溶液,反应的离子方程式为 。
(6)由元素A、D、J组成的既含有离子键又含有共价键的化合物的化学式为 。
 在K2Cr2O7 + 14HCl="2KCl" + 2CrCl3 + 3Cl2↑+7H2O反应中,_________元素被氧化,_________是氧化剂,还原产物是,电子转移的数目是_________。
在K2Cr2O7 + 14HCl="2KCl" + 2CrCl3 + 3Cl2↑+7H2O反应中,_________元素被氧化,_________是氧化剂,还原产物是,电子转移的数目是_________。
①空气②氯气③氢氧化钠④熔融状态的硝酸钾⑤铁⑥葡萄糖⑦硫酸溶液⑧氯化铁溶液⑨酒精⑩硫酸铜(将序号填入下面划线中)
在以上物质中,属于 电解质的是___________,属于非电解质的是___________,
电解质的是___________,属于非电解质的是___________,
属于单质的是______________,属于混合物的是________________,能导电的 是_____ ______,属于酸的是___________,属于碱的是__________,属于盐(包括盐溶液)的是__________。
是_____ ______,属于酸的是___________,属于碱的是__________,属于盐(包括盐溶液)的是__________。
甲、乙两同学为探究 与可溶性钡的强酸盐能否反应生成白色
与可溶性钡的强酸盐能否反应生成白色 沉淀,用下图所示装置进行实验(夹持装置和A中加执装置已略,气密性已检验)
沉淀,用下图所示装置进行实验(夹持装置和A中加执装置已略,气密性已检验) 
实验操作和现象:
| 操作 |
现象 |
| 关闭弹簧夹,滴加一定量浓硫酸,加热 |
A.中有白雾生成,铜片表面产生气泡 B.中有气泡冒出,产生大量白色沉淀 C.中产生白色沉淀,液面上方略显红棕色并逐渐消失 |
打开弹簧夹,通入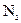 ,停止加热,一段时间后关闭 ,停止加热,一段时间后关闭 |
|
| 从B、C中分别取少量白色沉淀,加稀盐酸 |
均未发现白色沉淀溶解 |
(1)A中反应的化学方程式是 。
。
(2)C中白色沉淀是。
(3)C中液面上方生成红棕色气体的化学方程式是。
(4)分析B中不溶于稀盐酸的沉淀产生的原因,甲同学认为是空气中的氧气参与反应,乙同学认为是白雾(硫酸酸雾)参与反应。
①为证实各自的观点,在原实验基础上;甲同学在原有操作之前通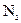 一段时间,目的是。乙同学在A、B间增加盛有饱和
一段时间,目的是。乙同学在A、B间增加盛有饱和 溶液的洗气瓶D,D中反应的离子方程式是。
溶液的洗气瓶D,D中反应的离子方程式是。
②各自进行实验,B中现象:
| 甲 |
大量不溶于稀盐酸的白色沉淀 |
| 乙 |
少量不溶于稀盐酸的白色沉淀 |
用离子方程式解释乙同学观察到的实验现象

(不必配平)。
(5)若将(4)中两同学的方案进行联合试验,发现B中无沉淀生成,而C中产生白色沉淀,由此得出的结论是。
由熔盐电解法获得的粗铝含有一定量的金属钠和氢气,这些杂质可采用吹气精炼法除去。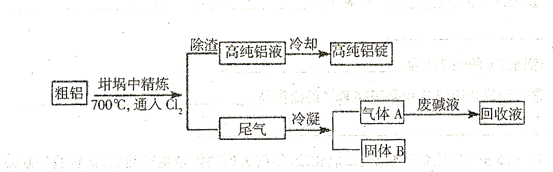
(注:NaCl熔点为801℃;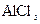 在181℃升华)
在181℃升华)
(1) 精炼前,需清除坩埚表面的氧化铁和石英砂,防止精炼时它们分别与铝发生置换反应产生新的杂质,相关的化学方程式为①
精炼前,需清除坩埚表面的氧化铁和石英砂,防止精炼时它们分别与铝发生置换反应产生新的杂质,相关的化学方程式为① 和②。
和②。
(2)将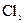 连续通人坩埚中的粗铝熔体,杂质随气泡上浮除去。气泡的主要成分除
连续通人坩埚中的粗铝熔体,杂质随气泡上浮除去。气泡的主要成分除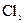 外还含有,固态杂质粘附于气泡上,在熔体表面形定浮渣,浮渣中肯定存在。
外还含有,固态杂质粘附于气泡上,在熔体表面形定浮渣,浮渣中肯定存在。
(3)在用废碱液处理A的过程中,所发生反应的离子方程式为
。
实验室以食盐、二氧化碳、氨气为原料模拟生产纯碱,该实验先制得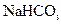 ,进而制取纯碱。主要装置如下:
,进而制取纯碱。主要装置如下: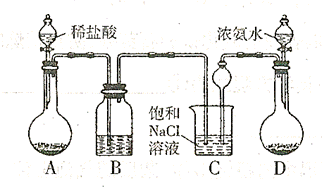
请回答下列问题:
(1)A中发生反应的离子方程式为;B中所盛的溶液为
。
(2)D装置用来产生 ,则固体D可以是(只填一种;C装置中球形漏斗的作用是 。
,则固体D可以是(只填一种;C装置中球形漏斗的作用是 。
(3)向C中通人气体时,应先通,理由是
。C中反应的总的化学方程式为
。
(4)C中分离出的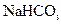 晶体可能含有的杂质有,用该
晶体可能含有的杂质有,用该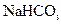 晶体制取纯碱时,有的杂质不会影响纯碱的纯度。原因是
晶体制取纯碱时,有的杂质不会影响纯碱的纯度。原因是
(用化学方程表示)。
(5)写出用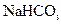 制取纯碱的化学方程式。
制取纯碱的化学方程式。