氮化铝(AlN)具有耐高温、抗冲击、导热性好等优良性质,被广泛应用于电子工业、陶瓷工业等领域。在一定条件下,氮化铝可通过如下反应合成:
Al2O3 + N2 + 3C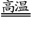 2AlN + 3CO↑
2AlN + 3CO↑
下列叙述不正确的是
| A.在氮化铝的合成反应中,N2是还原剂 |
| B.在氮化铝的合成反应中,C是还原剂 |
| C.氮化铝中氮元素的化合价为-3 |
| D.上述反应中每生成1molAlN,转移3 mol e- |
能正确表示下列反应的离子方程式是()
| A.浓盐酸与铁屑反应:2Fe+6H+=2Fe3++3H2↑ |
| B.钠与CuSO4溶液反应:2Na+Cu2+=Cu↓+2Na+ |
| C.NaHCO3溶液与稀H2SO4反应:CO32-+2H+=H2O+CO2↑ |
| D.向FeCl3溶液中加入Mg(OH)2:3Mg(OH)2+2Fe3+=2Fe(OH)3+3Mg2+ |
某溶液可能含有Cl-、SO42-、CO32-、NH4+、Fe3+、Al3+和K+。取该溶液100mL,加入过量NaOH溶液,加热,得到0.02mol气体,同时产生红褐色沉淀;过滤,洗涤,灼烧,得到1.6g固体;向上述滤液中加足量BaCl2溶液,得到4.66g不溶于盐酸的沉淀。由此可知原溶液中
| A.至少存在5种离子 |
| B.Cl-一定存在,且c(Cl‑)≥0.4mol/L |
| C.SO42-、NH4+、一定存在,Cl-可能不存在 |
| D.CO32-、Al3+一定不存在,K+可能存在 |
能正确表示下列反应的离子反应方程式为
| A.NH4HCO3溶于过量的浓KOH溶液中:NH4++ HCO3-+2OH-= CO32-+ NH3↑+2 H2O |
| B.向明矾溶液中滴加Ba(OH)2溶液,恰好使SO42-沉淀完全:2Al3++3SO42-+3Ba2++6OH -="2" Al(OH)3↓+3BaSO4↓ |
| C.向FeBr2溶液中通入足量氯气:2Fe2++4Br-+3Cl2="2" Fe3++2 Br2+6 Cl- |
| D.醋酸除去水垢:2H++CaCO3=Ca2++ CO2↑+ H2O |
水溶液中能大量共存的一组离子是
| A.Na+、Al3+、Cl-、CO32- | B.H+、Na+、Fe2+、MnO4- |
| C.K+、Ca2+、Cl-、NO3- | D.K+、NH4+、OH-、SO42- |
某钠盐溶液中可能含有NO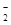 、SO42-、SO32、
、SO42-、SO32、 、Cl-、I-等阴离子。某同学取5份此溶液样品,分别进行了如下实验:
、Cl-、I-等阴离子。某同学取5份此溶液样品,分别进行了如下实验:
①用pH计测得溶液的pH大于7
②加入盐酸,产生有色刺激性气体
③加入硝酸酸化的AgNO3溶液产生白色沉淀,且放出有色刺激性气体
④加足量BaCl2溶液,产生白色沉淀,该沉淀溶于稀硝酸且放出气体,将气体通入品红溶液,溶液不褪色
⑤加足量BaCl2溶液,产生白色沉淀,在滤液中加入酸化的(NH4)2Fe(SO4)2溶液,再滴加KSCN溶液,显红色
该同学最终确定在上述六种离子中仅含有NO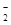 、
、 、Cl-三种阴离子.
、Cl-三种阴离子.
请分析,该同学只需要完成上述哪几个实验,即可得出此结论.( )
| A.①②④⑤ | B.③④ |
| C.③④⑤ | D.②③⑤ |