质量为ag的铜丝,在空气中灼热变黑,趁热放入下列物质中,铜丝变红,质量仍为ag的是
| A.盐酸 | B.CH3COOH | C.C2H5OH | D.HNO3 |
下图是425℃时N2与H2反应过程中能量变化的曲线图。下列叙述正确的是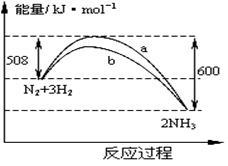
A.该反应的热化学方程式为:N2+3H2 2NH3 △H=-92kJ·mol-1 2NH3 △H=-92kJ·mol-1 |
B.一定条件下N2+3H2 2NH3达到平衡时,3v正(H2)=2v逆(NH3) 2NH3达到平衡时,3v正(H2)=2v逆(NH3) |
| C.加入催化剂,该反应的反应热发生改变 |
| D.温度、容器体积一定,通入1molN2和3molH2反应后放出的热量为Q1kJ,若通入2 molN2和6 molH2反应后放出的热量为Q2kJ,则有184>Q2>2Q1 |
已知下列反应的热化学方程式:
6C(s)+5H2(g)+3N2(g)+9O2(g)=2C3H5(ONO2)3(l) △H1
2 H2(g)+ O2(g)= 2H2O(g) △H2
C(s)+ O2(g)=CO2(g) △H3
则反应4C3H5(ONO2)3(l)=12CO2(g)+10H2O(g) +O2(g) +6N2(g)的△H为
| A.12△H3+5△H2-2△H1 | B.2△H1-5△H2-12△H3 |
| C.12△H3-5△H2-2△H1 | D.△H1-5△H2-12△H3 |
已知1 g氢气完全燃烧生成水蒸气时放出热量121 kJ,且氧气中1 mol O==O键完全断裂时吸收热量496 kJ,水蒸气中1 mol H—O键形成时放出热量463 kJ,则氢气中1 mol H—H键断裂时吸收热量为
| A.920 kJ | B.557 kJ | C.436 kJ | D.188 kJ |
可逆反应aA(s)+bB(g) cC(g) +dD(g), 当其他条件不变时,某物质在混合物中的含量与温度(T)、压强(p)的关系如图所示,据图分析,以下正确的是
cC(g) +dD(g), 当其他条件不变时,某物质在混合物中的含量与温度(T)、压强(p)的关系如图所示,据图分析,以下正确的是
| A.P1>P2,a+b=c+d |
| B.Pl<P2,b=c+d |
| C.T1>T2,正反应放热 |
| D.Tl<T2,正反应吸热 |
某温度下,在2L的密闭容器中,加入1molX(g)和2molY(g)发生反应:
X(g)+m Y(g) 3Z(g),平衡时,X、Y、Z的体积分数分别为30%、60%、10%。在此平衡体系中加入1molZ(g),再次达到平衡后,X、Y、Z的体积分数不变。下列叙述不正确的是
3Z(g),平衡时,X、Y、Z的体积分数分别为30%、60%、10%。在此平衡体系中加入1molZ(g),再次达到平衡后,X、Y、Z的体积分数不变。下列叙述不正确的是
| A.m=2 |
| B.两次平衡的平衡常数相同 |
| C.X与Y的平衡转化率之比为1:1 |
| D.第二次平衡时,Z的浓度为0.4 mol·L-1 |