下列实验现象所对应的离子方程式不正确的是( )
| |
实验 |
现象 |
离子方程式 |
| A |
 |
在空气中放置一段时间后,溶液呈蓝色 |
4H+ +4I- +O2 =" " 2I2+ 2H2O |
| B |
 |
溶液由浅绿色变为红色 |
2Fe2++Cl2=2Fe3++2Cl- Fe3++ 3SCN- = Fe(SCN)3 |
| C |
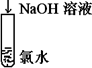 |
溶液由黄绿色变为无色 |
Cl2+2OH- = Cl-+ ClO-+ H2O |
| D |
 |
有白色沉淀生成,溶液由红色变为无色 |
Ba2++OH-+ H++ SO42-=BaSO4↓+ H2O |
A、B、C、X均为中学化学常见物质,一定条件下它们有如下转化关系(其它产物已略去),下列说法正确的是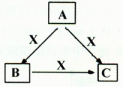
A.若X为Cl2,则C可能为FeCl3
B.若X为KOH溶液,则A可能为AlCl3
C.若X为O2,则A可为有机物乙醇,也可为硫化氢
D.若A、B、C均为焰色反应呈黄色的化合物,则X一定为CO2
有一无色溶液,可能含有K+、A13+、Mg2+、NH4+、Cl—、SO42—、HCO3—、MnO4—中的几种。为确定其成分,做如下实验:①取部分溶液,加入适量Na2O2固体,产生无色无味的气体和白色沉淀,再加入足量的NaOH溶液后白色沉淀部分溶解;②另取部分溶液,加入HNO3酸化的Ba(NO3)2溶液,有白色沉淀产生。下列推断正确的是()
| A.肯定有Al3+、Mg2+、HCO3— | B.肯定有A13+、Mg2+、SO42— |
| C.肯定没有HCO3—、MnO4—、NH4+、K+ | D.不能确定K+、Cl—是否存在 |
向100 mL 0.1 mol·L-1硫酸铝铵[NH4Al(SO4)2]溶液中逐滴滴入0.1 mol·L-1 Ba(OH)2溶液。随着 Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如图所示。则下列说法中正确的是( )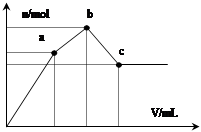
| A.a点发生反应的离子方程式是:Al3++2SO42-+2Ba2++3OH— = Al(OH)3↓+2BaSO4↓ |
| B.b点消耗Ba(OH)2溶液体积为200mL |
| C.从a→b 、b→c点过程中发生反应的离子方程式依次为: NH4++OH-=NH3·H2O Al(OH)3+OH-=AlO2-+2H2O |
| D.沉淀的质量:a点>c点 |
为精确测定工业纯碱中碳酸钠的质量分数(含少量NaCl),准确称量W0 g样品进行实验,下列实验方法所对应的实验方案和测量数据合理(除W0外)的是()
| 实验方法 |
实验方案 |
测量数据 |
|
| A. |
滴定法 |
将样品配成100 mL溶液,取10 mL,加入甲基橙,用标准盐酸滴定 |
消耗盐酸的体积 |
| B. |
量气法 |
将样品与盐酸反应,生成的气体全部被碱石灰吸收 |
碱石灰增重 |
| C. |
重量法 |
样品放入烧瓶中,置于电子天平上,加入足量盐酸 |
减轻的质量 |
| D. |
量气法 |
将样品与盐酸反应,气体通过排水量气装置量气 |
排水体积 |
下列物质的制备操作,可以达到实验目的是()
| A.向氯化铁溶液中不断加入氢氧化钠溶液制备氢氧化铁胶体 |
| B.用铜粉和硫粉混合加热制备硫化铜 |
| C.用铁做阳极电解硫酸钠溶液可以制得氢氧化亚铁 |
| D.向铝盐溶液中不断滴入过量烧碱溶液制备Al(OH)3 |