常温下,下列对有关溶液的判断不正确的是( )
| A.Na2CO3溶液中,c(OH-) = c(H+)+c(HCO3–)+c(H2CO3) |
B.温度相同、浓度相同的①(NH4)2SO4、②NaNO3、③NH4HSO4、④NH4NO3、⑤ 、⑥CH3COONa溶液,它们的pH值由小到大的排列顺序是:③①④②⑥⑤ 、⑥CH3COONa溶液,它们的pH值由小到大的排列顺序是:③①④②⑥⑤ |
| C.NaA溶液的pH=8,c(Na+)-c(A-) = 0.99×10-6 mol/L |
| D.10 mL pH = 12的氢氧化钠溶液中加入pH = 2的HA至pH刚好等于7,所得溶液体积V(总)≤20mL |
已知:将Cl2通入适量KOH溶液,产物中可能有KCl、KClO、KClO3,且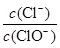 的值与温度高低有关。当n(KOH)=a mol时,下列有关说法错误的是
的值与温度高低有关。当n(KOH)=a mol时,下列有关说法错误的是
A.若某温度下,反应后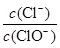 =11,则溶液中 =11,则溶液中 = = |
B.参加反应的氯气的物质的量等于 a mol a mol |
C.改变温度,产物中KClO的最大理论产量为 a mol a mol |
D.改变温度,产物中KClO3的最大理论产量为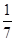 a mol a mol |
下列装置应用于实验室制氯气并回收氯化锰的实验,能达到实验目的的是

甲 乙 丙 丁
| A.用装置甲制取氯气 |
| B.用装置乙除去氯气中的少量氯化氢 |
| C.用装置丙分离二氧化锰和氯化锰溶液 |
| D.用装置丁蒸干氯化锰溶液制MnCl2·4H2O |
茶叶中铁元素的检验可经以下四个步骤完成,各步骤中选用的实验用品不能都用到的是
| A.将茶叶灼烧灰化,选用①、②和⑨ |
| B.用浓硝酸溶解茶叶并加蒸馏水稀释,选用④、⑥和⑦ |
| C.过滤得到滤液,选用④、⑤和⑦ |
| D.检验滤液中的Fe3+,选用③、⑧和⑩ |
设NA表示阿伏加德罗常数的值,下列有关NA的叙述中正确的有
①标准状况下,20 g重水(D2O)中含有的电子数为10NA
②0.5 mol Fe2+与足量的H2O2溶液反应,转移0.5 NA个电子
③将2 mol NO和1 mol O2混合后,体系中的分子总数为3NA
④乙烯和环丙烷组成的42 g混合气体中氢原子的个数为6NA
⑤2 mol·L-1碳酸钠溶液中Na+的数目是2NA
⑥1 mol氯气溶解在水中得到的新制氯水中氢离子的数目是NA
⑦22.4 L的N2的共用电子对数为3NA
| A.3个 | B.4个 | C.5个 | D.全部正确 |
下列实验能达到目的的是
| A.只滴加氨水鉴别NaCl、AlCl3、MgCl2、Na2SO4四种溶液 |
| B.将NH4Cl溶液蒸干制备NH4Cl固体 |
| C.用萃取分液的方法除去酒精中的水 |
| D.用可见光束照射以区别溶液和胶体 |