为了研究MnO2与双氧水(H2O2)的反应速率,某学生加入少许的MnO2粉末于 50 mL密度为1.1g∙cm-3的双氧水溶液中,通过实验测定:在标准状况下放出气体的体积和时间的关系如右图所示。请依图回答下列问题: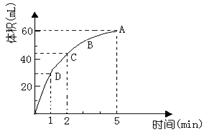
(1)实验时放出气体的总体积为 ___ ;
(2)放出一半气体所需要的时间为 ______ ;
(3)ABCD四点化学反应速率的由快到慢顺序为 ___________ ;
(4)在5min后,收集到的气体体积不再增加,原因是 。
一种“人工固氮”的新方法是在常温、常压、光照条件下,N2在催化剂表面与水发生反应生成NH3:N2+3H2O 2NH3+O2
2NH3+O2
进一步研究NH3生成量与温度的关系,部分实验数据见下表(反应时间3 h):
| T/℃ |
30 |
40 |
50 |
| 生成NH3量/(10-6 mol) |
4.8 |
5.9 |
6.0 |
请回答下列问题:
(1)50℃时从开始到3 h内以O2物质的量变化表示的平均反应速率为________ mol·h-1。
(2)该反应过程与能量关系可用如图表示,则反应的热化学方程式是____________。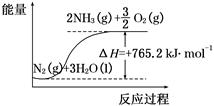
(3)与目前广泛应用的工业合成氨方法相比,该方法中固氮反应速率较慢。请提出可提高其反应速率且增大NH3生成量的建议:_______________________________________。
(4)工业合成氨的热化学方程式为N2(g)+3H2(g)  2NH3(g) ΔH=-92.4 kJ·mol-1。在某压强恒定的密闭容器中加入2 mol N2和4 mol H2,达到平衡时,N2的转化率为50%,体积变为10 L。求:
2NH3(g) ΔH=-92.4 kJ·mol-1。在某压强恒定的密闭容器中加入2 mol N2和4 mol H2,达到平衡时,N2的转化率为50%,体积变为10 L。求:
①该条件下的平衡常数为________;
②若向该容器中加入a mol N2、b mol H2、c mol NH3,且a、b、c均大于0,在相同条件下达到平衡时,混合物中各组分的物质的量与上述平衡相同。反应放出的热量________(填“>”“<”或“=”)92.4 kJ。
在2 L密闭容器内,800℃时反应2NO(g)+O2(g)  2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
| 时间(s) |
0 |
1 |
2 |
3 |
4 |
5 |
| n(NO)(mol) |
0.020 |
0.010 |
0.008 |
0.007 |
0.007 |
0.007 |
(1)写出该反应的平衡常数表达式:K=__________。已知K300℃>K350℃,则该反应是________热反应。
(2)如图中表示NO2变化曲线的是__________,用O2表示从0 s~2 s 内该反应的平均速率v=________。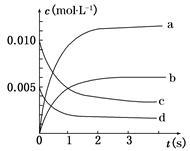
(3)能说明该反应已达到平衡状态的是__________。
a.v(NO2)=2v(O2)
b.容器内压强保持不变
c.v逆(NO)=2v正(O2)
d.容器内密度保持不变
(4)能使该反应的反应速率增大,且平衡向正反应方向移动的是__________。
a.及时分离出NO2气体
b.适当升高温度
c.增大O2的浓度
d.选择高效催化剂
利用光能和光催化剂,可将 CO2和 H2O(g)转化为 CH4和 O2。紫外光照射时,在不同催化剂(Ⅰ,Ⅱ,Ⅲ)作用下,CH4产量随光照时间的变化如图所示。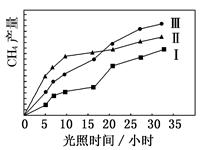
(1)在0~30 小时内,CH4的平均生成速率 vⅠ、vⅡ和vⅢ从大到小的顺序为________;反应开始后的 12 小时内,在第________种催化剂作用下,收集的 CH4最多。
(2)将所得 CH4与 H2O(g)通入聚焦太阳能反应器,发生反应:CH4(g)+H2O(g)  CO(g)+3H2(g)。该反应ΔH=+206 kJ·mol-1。
CO(g)+3H2(g)。该反应ΔH=+206 kJ·mol-1。
①画出反应过程中体系能量变化图(进行必要标注)。
②将等物质的量的CH4和 H2O(g)充入 1 L 恒容密闭反应器中,某温度下反应达到平衡,平衡常数 K = 27,此时测得 CO 的物质的量为 0.10 mol,求CH4的平衡转化率(计算结果保留两位有效数字)。
(3)已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g)ΔH=-802 kJ·mol-1。
写出由 CO2生成 CO 的热化学方程式____________________________________
已知下列两个反应:
反应Ⅰ:CO2(g)+H2(g)  CO(g)+H2O ΔH1
CO(g)+H2O ΔH1
反应Ⅱ:CO(g)+H2O(g)  CO2(g)+H2(g) ΔH2
CO2(g)+H2(g) ΔH2
(1)相同温度下,若上述反应Ⅰ的化学平衡常数为K1,反应Ⅱ的化学平衡常数为K2,那么K1·K2=________。
(2)反应Ⅰ化学平衡常数K1和温度t的关系如下表一:
| t/℃ |
700 |
800 |
850 |
1 000 |
1 200 |
| K1 |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
该反应的ΔH1__________0(选填“>”、“=”或“<”)。
(3)某温度下,反应Ⅰ的化学平衡常数为2.25。在该温度下,向甲、乙、丙三个恒容密闭容器中通入CO2(g)和H2(g),这两种物质的起始浓度如下表二:
| 起始浓度 |
甲 |
乙 |
丙 |
| c(CO2)(mol/L) |
0.01 |
0.02 |
0.02 |
| c(H2)(mol/L) |
0.01 |
0.01 |
0.02 |
反应速率最快的是________(填“甲”、“乙”或“丙”),平衡时,H2转化率最大的是________(填“甲”、“乙”或“丙”),丙中H2的转化率为________。
可逆反应:aA(g)+bB(g) cC(g)+dD(g);ΔH=Q,试根据图回答:
cC(g)+dD(g);ΔH=Q,试根据图回答: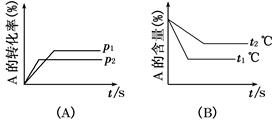
(1)压强p1比p2________(填“大”、“小”)。
(2)(a+b)比(c+d)________(填“大”、“小”)。
(3)温度t1℃比t2℃________(填“高”、“低”)。
(4)Q值是________(填“正”、“负”)。