(9分)研究NO2、SO2 、CO等大气污染气体的处理具有重要意义。
⑴NO2可用水吸收,相应的化学反应方程式为____________________________。利用反应6NO2+ 8NH3 7N2+12 H2O也可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是 L。
7N2+12 H2O也可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是 L。
(2)已知:2SO2(g)+O2(g) 2SO3(g) ΔH=-196.6 kJ·mol-1
2SO3(g) ΔH=-196.6 kJ·mol-1
2NO(g)+O2(g) 2NO2(g) ΔH=-113.0 kJ·mol-1
2NO2(g) ΔH=-113.0 kJ·mol-1
则反应NO2(g)+SO2(g) SO3(g)+NO(g)的ΔH= kJ·mol-1。
SO3(g)+NO(g)的ΔH= kJ·mol-1。
一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是 。
a.体系压强保持不变
b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变
d.每消耗1 mol SO3的同时生成1 molNO2
测得上述反应平衡时NO2与SO2体积比为1:6,则平衡常数K= 。
用黄铁矿可以制取 H2SO4,再用 H2SO4可以制取化肥(NH4)2SO4。煅烧含 FeS2 80.2% 的黄铁矿 75.0 t,最终生产出 79.2 t(NH4)2SO4。已知 NH3的利用率为 92.6%,H2SO4的利用率为 89.8%,试求黄铁矿制取 H2SO4时的损失率。
在120℃时,将气体A 3.88 g通过足量的 ,放出
,放出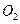 ,充分反应后固体的质量增加2.28 g,试通过计算判断气体 A的组成及各成分的质量。
,充分反应后固体的质量增加2.28 g,试通过计算判断气体 A的组成及各成分的质量。
为了测定某种碱金属的相对原子质量,有人设计了如图所示的实验装置。该装置(包括足量的水)的总质量为 。将质量为
。将质量为 的某碱金属单质放入水中,立即塞紧瓶塞,完全反应后再称量此装置的总质量为
的某碱金属单质放入水中,立即塞紧瓶塞,完全反应后再称量此装置的总质量为 。
。
(1)列出计算该碱金属相对原子质量的数学表达式;
(2)无水氯化钙的作用是什么?如果不用 ,测定的碱金属相对原子质量比实际值偏大还是偏小?说明理由。
,测定的碱金属相对原子质量比实际值偏大还是偏小?说明理由。
向含有0.8mol的稀硝酸溶液中慢慢加入22.4g的铁粉.假设反应分为两个阶段.第一阶段为:Fe+HNO3 Fe(NO3)3+NO↑+H2O
Fe(NO3)3+NO↑+H2O
(1)写出这两个阶段反应的离子方程式.
(2)求这两个阶段反应中,加入铁粉的物质的量和溶液中铁元素存在的形式.
(3)在图中画出溶液中Fe2+、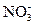 离子的物质的量随加入铁粉的物质的量变化的关系图像(纵坐标是溶液中离子的物质的量).
离子的物质的量随加入铁粉的物质的量变化的关系图像(纵坐标是溶液中离子的物质的量).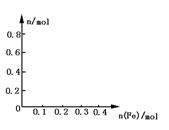
金属铜能被FeCl3的浓溶液腐蚀,其化学反应是:Cu+2FeCl3=2FeCl2+CuCl2。
现将有铜的印刷线路板浸入120mLFeCl3的浓溶液中,有9.6gCu被腐蚀掉。取出印刷线路板,向溶液中加入8.4g铁粉,经充分反应,溶液中还存在4.8g不溶物。则:
(1)溶液中存在那些离子?
(2)离子的浓度各是多少?(设溶液体积不变)