我国发射“神五”所用的长征2号火箭的主要燃料是偏二甲肼(C2H8N2),氧化剂是NO2,燃烧产物只有N2、CO2和H2O。有的国家用肼(N2H4)作为火箭发动机的燃料。NO2为氧化剂,反应生成N2和水蒸气。已知:
①N2(g)+2O2(g) === 2NO2(g) △H=+67.7kJ• mol-1,
②N2H4(g)+O2(g) === N2(g)+ 2H2O(g) △H=" -534" kJ• mol-1。
下列关于肼和NO2反应的热化学方程式中正确的是
| A.2N2H4(g)+2NO2(g) === 3N2(g) + 4H2O (l)△H=" -1135.7" kJ• mol-1 |
| B.2N2H4(g)+2NO2(g) ===2N2(g) +4H2O(l)△H=" -1135.7" kJ• mol-1 |
C.N2H4(g)+NO2(g) === N2(g) +2H2O(g )△H=" -1135.7" kJ• mol-1 N2(g) +2H2O(g )△H=" -1135.7" kJ• mol-1 |
| D.2N2H4(g) + 2NO2(g) ===3N2(g)+4 H2O (g)△H=" -1135.7" kJ• mol-1 |
几种短周期元素的原子半径及主要化合价如下表:
| 元素代号 |
X |
Y |
Z |
M |
N |
| 原子半径/pm |
186 |
160 |
143 |
75 |
74 |
| 主要化合价 |
+1 |
+2 |
+3 |
+5,-3 |
-2 |
下列叙述正确的是
A.XOH 的碱性比Y(OH)2的碱性强
B.一定条件下,M单质与N的常见单质直接生成MN2
C.X、Z、M的最高价氧化物的水化物之间两两相互反应
D.气态氢化物的稳定性M > N
已知N2(g)+3H2(g) 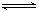 NH3(g)△H <0 ,SO2(g)+02(g)
NH3(g)△H <0 ,SO2(g)+02(g) 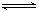 2S03(g),△H <0,不能用化学平衡移动原理说明的事实是
2S03(g),△H <0,不能用化学平衡移动原理说明的事实是
| A.合成氨应该在高压塔中下进行 |
| B.工业生产中,温度越低越好 |
| C.制取SO2中,O2适当过量,经济性好 |
| D.及时向合成氨气的塔里喷水,溶解、分离出氨气 |
已知氧化性:NO3- >Br2>Fe3+>I2还原性:I- > Fe2+ > Br- > Cl-。
在一种酸性溶液中,可能存在NO3-、I-、Cl-、Fe3+中的一种或几种离子,向该溶液中加入溴水,溴单质被还原,则以下推测中不正确的是
| A.一定有I- | B.可能Fe3+ | C.可能有Cl- | D.肯定没有NO3- |
将金属铜、铁置于氯化铁溶液中充分反应,下列对反应情况设想的评价正确的是
| 选项 |
反应情况设想 |
评价 |
| A |
当铁、铜均不剩余时,溶液中一定有 Fe2+、Cu2+,一定无Fe3+ |
正确,Fe3+和Fe、Cu均可反应 |
| B |
当铁、铜均有剩余时,溶液中一定有Fe2+、Cu2+,无Fe3+ |
正确,Fe和Cu与Fe3+都反应,故有Fe2+和Cu2+,无Fe3+ |
| C |
当铜有剩余,铁无剩余时,溶液中一定只有Fe2+,无Cu2+ |
正确,Cu有剩余,故无Cu2+ |
| D |
当铁有剩余,铜无剩余时,溶液中一定有Fe2+、Cu2+ |
不正确,不可能有Fe剩余,而铜不剩余,因为Fe比Cu优先于Fe3+反应 |
下列说法正确的是
| A.NA表示阿伏伽德罗常数,1molNa被完全氧化生成Na2O2,失去2NA个电子 |
| B.Na2O2用作呼吸面具的供氧剂涉及氧化还原反应 |
| C.小苏打的主要成分是碳酸钠 |
| D.NaHCO3的热稳定性大于Na2CO3 |