由硫酸钾、硫酸铝和硫酸组成的混合溶液,其pH=1,c(Al3+)=0.4mol·L-1,c(SO42-)=0.8mol·L-1,则c(K+)为( )
| A.0.15 mol·L-1 | B.0.2 mol·L-1 | C.0.3 mol·L-1 | D.0.4 mol·L-1 |
氢气在氯气中燃烧产生苍白色火焰。在反应过程中,破坏1 mol 氢气中的化学键消耗的能量为Q1kJ,破坏1 mol 氯气中的化学键消耗的能量为Q2KJ,形成1 mol 氯化氢中的化学键释放的能量为Q3kJ。下列关系式中正确的是
| A.Q1 + Q2>Q3 | B.Q1 + Q2<2Q3 |
| C.Q1 + Q2<Q3 | D.Q1 + Q2>2Q3 |
如图将锌片和铜片用导线连接后放入稀硫酸溶液中,发生原电池反应,下列叙述错误的是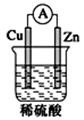
| A.溶液的pH增大 | B.溶液中的Zn2+浓度增大 |
| C.溶液中的SO42-浓度增大 | D.溶液的密度增大 |
意大利罗马大学的FulvioCacace等人获得了极具理论研究意义的气态N4分子,其分子结构如下图所示。已知断裂1 mol N—N吸收167 kJ热量,生成1 mol N≡N键放出942 kJ热量,根据以上信息判断,下列说法正确的是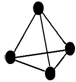
| A.1 mol N4转变成N2将放出882 kJ热量 |
| B.N4属于一种新型的化合物 |
| C.N4与N2互为同分异构体 |
| D.N4是由极性键组成分子 |
可逆反应3H2+N2 2NH3达到平衡的标志是
2NH3达到平衡的标志是
①消耗3 mol H2的同时生成2 mol NH3
②1个N≡N键断裂的同时,有3个H-H键形成
③H2、N2与NH3的物质的量之比为3∶1∶2
④1个N≡N键断裂的同时,有6个N-H键断裂
⑤1个N≡N键断裂的同时,有6个N-H键形成
| A.①②⑤ | B.②④ | C.①②③④ | D.全部 |
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如下图所示:下列描述正确的是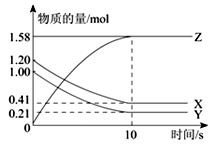
| A.反应开始到10 s,用Z表示的反应速率为0.158 mol/(L•s) |
| B.反应开始到10 s,X的物质的量浓度减少了0.79 mol/L |
| C.反应开始到10 s时,Y的转化率为79.0 % |
D.反应的化学方程式为:X(g)+Y(g)  Z(g) Z(g) |