.下列不能说明氯的非金属性比硫强的事实是
①HCl比H2S稳定 ②HCl和H2S的水溶液前者的的酸性强 ③HClO4酸性比H2SO4强
④Cl2能与H2S反应生成S ⑤Cl原子能得1个电子变成稳定离子而S原子能得两个电子
⑥Cl2与Fe反应生成FeCl3,S与Fe反应生成FeS
| A.②⑤ | B.①② | C.①②④ | D.①③⑤ |
灰锡(以粉末状存在)和白锡是锡的两种同素异形体。
已知:①Sn(s,白)+2HCl(aq)="=" SnCl2(aq)+H2(g) ΔH1
②Sn(s,灰)+2HCl(aq)="=" SnCl2(aq)+H2(g) ΔH2
③Sn(s,灰)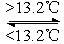 Sn(s,白) ΔH3 =" +2.1" kJ·mol-1
Sn(s,白) ΔH3 =" +2.1" kJ·mol-1
下列说法正确的是()
| A.ΔH3 =ΔH2+ΔH1 |
| B.锡在常温下以灰锡状态存在 |
| C.灰锡转化为白锡的反应是放热反应 |
| D.锡制器皿长期处在低于13.2 ℃的环境中,会自行毁坏 |
1g碳与适量水蒸气反应生成CO和H2,需吸收10.94kJ热量,此反应的热化学方程式为()
| A.C + H2O ="=" CO + H2ΔH= +131.28kJ·mol-1 |
| B.C(s)+ H2O(g) ="=" CO(g) + H2(g)ΔH= +10.94 kJ·mol-1 |
| C.C(s)+ H2O(l) ="=" CO(g) + H2(g)ΔH= +131.28kJ·mol-1 |
| D.C(s)+ H2O(g) ="=" CO(g) + H2(g)ΔH= +131.28kJ·mol-1 |
下列过程中△H小于零的是
| A.氯酸钾分解制氧气 | B.氯化铵分解得氨气 |
| C.碳酸钙分解得二氧化碳 | D.酸碱中和 |
未来新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生。下列属于未来新能源标准的是
①天然气②煤③核能④石油⑤太阳能⑥生物质能⑦风能⑧氢能
| A.①②③④ | B.⑤⑥⑦⑧ | C.③⑤⑥⑦⑧ | D.③④⑤⑥⑦⑧ |
下列说法正确的是()
| A.化学反应除了生成新的物质外,还伴随着能量的变化 |
| B.据能量守恒定律,反应物的总能量一定等于生成物的总能量 |
| C.放热的化学反应不需要加热就能发生 |
| D.吸热反应不加热就不会发生 |