下列实验操作中正确的是:
| A.分液操作时,分液漏斗中的下层液体由下口放出,然后再将上层液体由下口放出 |
| B.用胶头滴管向试管滴加液体时,滴管尖端应紧靠试管内壁 |
| C.用浓硫酸配制一定物质的量浓度的稀硫酸时,浓硫酸溶于水后,应冷却至室温才能转移到容量瓶中 |
| D.萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 |
下列关于苯乙酸丁酯的描述不正确的是()
| A.分子式为C12H16O2 |
| B.有3种不同结构的苯乙酸丁酯 |
| C.既能发生加成反应,又可发生取代反应 |
| D.在酸、碱溶液中都能发生反应 |
药物是人们生活的必备品之一,下列药物的主要成分都能发生以下四种反应的是 ()
①取代反应②加成反应③水解反应④中和反应
| A.维生素 | B.阿司匹林 | C.芬必得 | D.扑热息痛 |
下列实验操作中正确的是()
| A.制取溴苯:将铁屑、溴水、苯混合加热 |
| B.实验室制取乙酸乙酯:先加入浓硫酸,再加无水乙醇,最后滴入乙酸 |
| C.鉴别甲苯和苯:向甲苯和苯中分别滴入酸性KMnO4溶液,振荡,观察是否褪色 |
| D.检验卤代烃中的卤原子:加入NaOH溶液共热,再加AgNO3溶液,观察沉淀的颜色 |
下列关于有机化合物的叙述不正确的是()
| A.新制的氢氧化铜可以检验病人是否患有糖尿病 |
| B.三氯甲烷可以做麻醉剂,它和四氯化碳都是重要的有机溶剂 |
| C.根据金属钠与水、乙醇、乙酸反应剧烈程度的不同,可以说明分子中羟基上氢原子的活泼性不同 |
| D.蛋白质、淀粉、纤维素水解的最终产物都是纯净物 |
下列叙述不正确的是
| A.乙烯和植物油都能使酸性高锰酸钾褪色 |
| B.苯、乙酸都可与钠反应生成氢气 |
C.聚乙烯的结构简式为: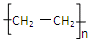 |
| D.灼烧闻气味可以区分棉织物和毛织物 |