一定条件下将2mol SO2和2mol SO3气体混合于一固定容积的密闭容器中,发生反应:
2SO2+O2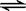 2SO3,平衡时SO3体积分数为n %,在相同温度下,分别按下列配比在上述容器中放入起始物质,平衡时SO3的体积分数大于n %的是 ( )
2SO3,平衡时SO3体积分数为n %,在相同温度下,分别按下列配比在上述容器中放入起始物质,平衡时SO3的体积分数大于n %的是 ( )
| A.2 mol SO2+0.5mol O2 | B.6 mol SO2+ 1 mo+l O2+ 2 SO3 |
| C.4 mol SO2+ 1 mol O2 | D.3 mol SO2+ 0.5 mol O2+ 1 SO3 |
2009年10月1日为庆祝祖国60华诞的联欢晚会在北京天安门广场举行,当晚8时许,璀璨的焰花从天安门广场四面八方腾空而起、交相辉映,把整个联欢晚会现场烘托得热烈喜庆。其中开篇"60"字样的高空焰火,象征民族大团结的56个“笑脸”、60支和平鸽让数万观众眼前为之一亮。这写都与高中化学中“焰色反应”知识相关。下列说法中正确的是()
| A.焰色反应均应透过蓝色钴玻璃观察 |
| B.NaC1与Na2CO3灼烧时火焰颜色相同 |
| C.非金属单质燃烧时火焰均为无色 |
| D.所有金属及其化合物灼烧时火焰均有颜色 |
“纳米材料”是粒子直径为1nm~100nm的材料,纳米碳就是其中的一种。某研究所将纳米碳均匀的分散到蒸馏水中,得到的物质 ①是溶液 ②具有介稳性 ③能产生丁达尔效应 ④属于分散系 ⑤不能透过滤纸 ⑥静止后会出现黑色沉淀。其中正确的是()
| A.①④⑥ | B.②③⑤ | C.②③④ | D.①③④⑥ |
某浓度的硝酸与过量的铁粉反应生成标准状况下N2O气体4.48L。若改用铝粉反应(生成NO气体),则最终可溶解铝粉的质量为
| A.8.9g | B.9.0g | C.13.5g | D.27.0g |
爱迪生蓄电池在放电和充电时的反应为:
Fe +NiO2+2H2O  Fe(OH)2+ Ni(OH)2,下列有关该电池的叙述中正确的是
Fe(OH)2+ Ni(OH)2,下列有关该电池的叙述中正确的是
| A.放电时Fe作负极,放电时溶液中的阳离子向正极移动 |
| B.充电时阳极的电极反应式为:Fe(OH)2 +2e-="=" Fe + 2OH- |
| C.充电时电池上标注“+”的电极应与外接电源的负极相连 |
| D.该蓄电池可能用稀H2SO4作电解质溶液 |
常温下,下列叙述不正确的是
| A.pH=3弱酸溶液与pH=11的强碱溶液等体积混合后溶液呈酸性 |
| B.pH=5的硫酸溶液稀释到原来的500倍,稀释后c(SO42-)与c(H+)之比约为1:10 |
| C.0.1mol/L的Na2S溶液中粒子浓度关系:c(OH-)= c(HS-)+ 2c(H2S) +c(H+) |
| D.中和10mL 0.1mol/L 醋酸与100mL 0.01mol/L醋酸所需的NaOH物质的量不同 |