将0.3mol的气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5kJ热量,表示乙硼烷燃烧热的热化学方程式为______ __________。又已知:H2O(g)=H2O(l);△H2=-44.0kJ/mol,则11.2L(标准状况)乙硼烷完全燃烧生成气态水时放出的热量是_____________kJ。
实验室合成乙酸乙酯的步骤如下:在圆底烧瓶内加入乙醇、浓硫酸和乙酸,瓶口竖直安装通有冷却水的冷凝管(使反应混合物的蒸气冷凝为液体流回烧瓶内),加热回流一段时间后换成蒸馏装置进行蒸馏,得到含有乙醇、乙酸和水的乙酸乙酯粗产品。
请回答下列问题:
(1)在烧瓶中除了加入乙醇、浓硫酸和乙酸外,还应放入___,目的是_____。
(2)反应中加入过量的乙醇,目的是_____________。
(3)现拟分离粗产品乙酸乙酯、乙酸和乙醇的混合物下列框图是分离操作步骤流程图:
则试剂a是:____________,分离方法I是____________,分离方法II是____________,
试剂b是______________,分离方法III是______________。
(4)甲、乙两位同学欲将所得含有乙醇、乙酸和水的乙酸乙酯粗产品提纯,在未用指示剂的情况下,他们都是先加NaOH溶液中和酯中过量的酸,然后用蒸馏法将酯分离出来。甲、乙两人实验结果如下:
甲得到了显酸性的酯的混合物;乙得到了大量水溶性的物质。
丙同学分析了上述实验目标产物后认为上述实验没有成功。试解答下列问题:
①甲实验失败的原因是:_______________________________________________
②乙实验失败的原因是:_______________________________________________
已知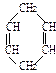 可简写为
可简写为 。现有某化合物W的分子结构可表示为:
。现有某化合物W的分子结构可表示为: 。
。
(1)W的分子式为;(2)W的一氯代物有种。
(3)下列有关W的说法不正确的是(填编号);
a.能发生还原反应 b.能发生氧化反应 c.能发生加聚反应
d.等质量的W与苯分别完全燃烧所消耗的氧气量,前者大
(4)写出W的芳香族同分异构体(能发生聚合反应)的结构简式,该聚合反应的化学方程式为。
(5)W属于(填编号)。
a.芳香烃 b.环烃 c.不饱和烃 d.炔烃
( 6 分)Ⅰ.有机物A的红外光谱图分别如下:
(1)符合该条件的相对分子质量最小的A的结构简式为:_________________________________。
Ⅱ.相对分子质量不超过100的有机物B,既能与金属钠反应产生无色气体,又能与碳酸钠反应产生无色气体,还可以使溴的四氯化碳溶液褪色。 B完全燃烧只生成CO2和H2O。经分析其含氧元素的质量分数为37.21%。经核磁共振检测发现B的氢谱如下:
(2)B的结构简式为:___________________________________。
(8分)要除去下表中所列有机物中的杂质(括号内为杂质),从(1)中选择适宜的试剂,从(2)中选择分离提纯的方法,用序号填入表中。
(1)试剂:a.浓硫酸 b.氢氧化钠 c.生石灰 d.碳酸钠 e.水 f.浓溴水
(2)方法:A.过滤 B.分液 C.蒸馏
| 要提纯的物质(杂质) |
CH3CH2Br (C2H5OH) |
C2H5OH (H2O) |
CH3COOCH2 CH3 (CH3COOH) |
C6H5Br (Br2) |
| 选用试剂(1) |
||||
| 分离方法(2) |
(共13分)有机化学知识在生活中应用广泛。
(1)糖类、油脂和蛋白质是动物性和植物性食物中的基本营养物质。
下列有关说法中,正确的是;
A.棉、麻、木材、蚕丝的主要成分都是纤维素
B.油脂是产生能量最高的营养物质
C.蛋白质在人体内发生水解最终生成氨基酸
D.糖类都是有甜味的物质
E.淀粉、纤维素、蛋白质都是天然高分子化合物
(2)实验室合成乙酸乙酯的步骤如下:在圆底烧瓶内加入乙醇、浓硫酸和乙酸,瓶口竖直安装通有冷却水的冷凝管(使反应混合物的蒸气冷凝为液体流回烧瓶内),加热回流一段时间后换成蒸馏装置进行蒸馏(如下图所示),得到含有乙醇、乙酸和水的乙酸乙酯粗产品。请回答下列问题:(已知:乙醇、乙酸、乙酸乙酯的沸点依次是78.4℃、118℃、77.1℃)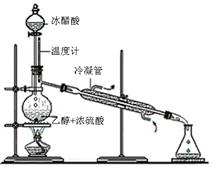
①在烧瓶中除了加入乙醇、浓硫酸和乙酸外,还应放入几块碎瓷片,其目的是;
②生成乙酸乙酯的反应是可逆反应,反应物不能完全变成生成物,反应一段时间后,就达到了该反应的限度,即达到化学平衡状态。下列描述能说明该反应已达到化学平衡状态的有(填序号);
A.单位时间里,生成1mol乙酸乙酯,同时生成1mol水
B.单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸
C.单位时间里,消耗1mol乙醇,同时消耗1mol乙酸
D.正反应的速率与逆反应的速率相等
E.混合物中各物质的浓度不再变化
③现拟分离含乙酸、乙醇和水的乙酸乙酯粗产品,下图是分离操作步骤流程图。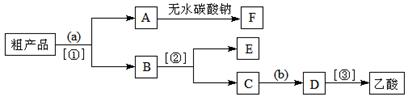
试剂a是,分离方法①是;分离方法②是,试剂b是;
④写出C → D 反应的化学方程式。