20℃时,饱和KCl溶液的密度为1.174g·cm-3,物质的量浓度为4.0mol·L-1,则下列说法中正确的是
| A.将此溶液蒸发部分水,再恢复到20℃时,溶液密度一定大于1.174 g·cm-3 |
B.此溶液中KCl的质量分数为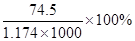 |
| C.密度大于1.174 g·cm-3的KCl溶液是过饱和溶液 |
| D.25℃时,饱和KCl溶液的浓度大于4.0 mol·L-1科网 |
温室时,将浓度和体积分别为c1、v1的NaOH溶液和c2、v2的CH3COOH溶液相混合,下列关于该混合溶液的叙述错误的是
| A.若PH>7时,则一定是c1v1=c2v2 |
| B.在任何情况下都是c(Na+)+c(H+)=c(CH3COO-)+c(OH-) |
| C.当pH=7时,若V1=V2,则一定是c2<c1 |
| D.若V1=V2,C1=C2,则c(CH3COO-)+C(CH3COOH)=C(Na+) |
常温下0.1mol·L-1醋酸溶液的pH=a,下列能使溶液pH=(a+1)的措施是
| A.将溶液稀释到原体积的10倍 | B.加入适量的醋酸钠固体 |
| C.加入等体积0.2 mol·L-1盐酸 | D.提高溶液的温度 |
25℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:
Sn(s)+Pb2+(aq) Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如下图所示。
Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如下图所示。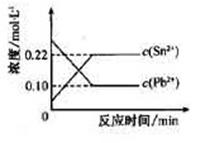
下列判断正确的是
| A.往平衡体系中加入金属铅后,c(Pb2+)增大 |
| B.往平衡体系中加入少量Sn(NO3)2固体后,c(Pb2+)变小 |
| C.升高温度,平衡体系中c(Pb2+)增大,说明该反应△H>0 |
| D.25℃时,该反应的平衡常数K=2.2 |
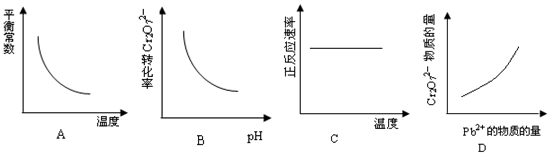
下列说法正确的是
| A.一定温度下,反应MgCl2(1)=Mg(1)+ Cl2(g)的△H>0△S>0 |
B.水解反应NH4++H2O NH3·H2O+H+达到平衡后,升高温度平衡逆向移动 NH3·H2O+H+达到平衡后,升高温度平衡逆向移动 |
| C.铅蓄电池放电时的负极和充电时的阳极均发生还原反应 |
| D.对于反应2H2O2=2H2O+O2↑, 加入MnO2或升高温度都能加快O2的生成速率 |
电镀废液中Cr2O72-可通过下列反应转化成铬黄(PbCrO4):
Cr2O72-(aq)+2Pb2+(aq)+H2O(l) 2 PbCrO4(s)+2H+(aq) ΔH< 0
2 PbCrO4(s)+2H+(aq) ΔH< 0
该反应达平衡后,改变横坐标表示的反应条件,下列示意图正确的是