阿伏加德罗常数约为6.02×1023 mol-1,下列叙述正确的是
| A.2.24 L CO2中含有的原子数为0.3×6.02×1023 |
| B.0.1 L 3 mol·L-1的NH4NO3溶液中含有的NH4+数目为0.3×6.02×1023 |
| C.5.6 g铁粉与硝酸反应失去的电子数一定为0.3×6.02×1023 |
| D.4.5 g SiO2晶体中含有的硅氧键数目为0.3×6.02×1023 |
下列物质中,分子的空间结构为正四面体的是………………………………()
| A.甲烷 | B.乙烯 | C.乙炔 | D.苯 |
铜锌原电池是最早被研究的电池。关于该电池的说法中正确的是()
| A.铜片是负极 | B.锌变成了锌离子 |
| C.电子从铜片经导线流向锌片 | D.铜片表面没有气泡 |
下列物质不能与氢氧化钠溶液反应的是………………………()
| A.Fe2O3 | B.Al(OH)3 | C.NaHCO3 | D.H2SiO3 |
下图是配制一定物质的量浓度溶液的过程示意图。下列说法中错误的是……()
| A.所配制的Na2CO3溶液的物质的量浓度为1.0 mol/L |
| B.操作2是将溶解的Na2CO3溶液转移到容量瓶中 |
| C.操作4是滴加水至溶液凹液面的最低点与刻度线平齐 |
| D.操作5中,定容摇匀后发现液面低于刻度线,要继续加水至液面与刻度线平齐 |


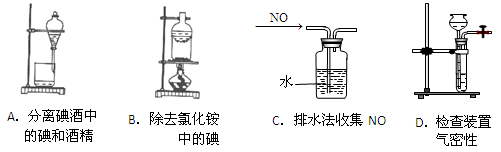
下列装置所示的实验中,能达到实验目的的是…………………………………()