请将6种物质: N2O、FeSO4、Fe(NO3)3、HNO3和Fe2(SO4)3 H2O分别填入下面对应的横线上,组成一个配平的化学方程式:方程式为:
(1) + → + + +
(2)反应物中发生氧化反应的物质是 ,被还原的元素是 。
(3)反应中1mol氧化剂参加反应时转移电子的物质的量为 mol
光伏并网发电并使用半导体(LED)照明可以节约大量能源。已知发出白光的LED是由氮化镓(GaN)芯片和钇铝石榴石(YAG,化学式:Y3Al5O12)芯片封装在一起做成的,如图所示。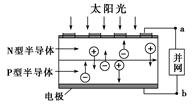
(1)砷与氮位于同主族,砷化镓也是半导体材料,它的化学式为________。
(2)用简单氧化物形式表示YAG的组成:________。
(3)下列有关光伏并网发电的叙述正确的是________(填序号)。
①LED是新型无机高分子材料
②电流从a流向b
③光伏电池是将太阳能直接转化为电能
④图中N型半导体为正极,P型半导体为负极
⑤如果工业上用光伏电池并网发电精炼粗铜,a极连接精铜电极
化合物X是一种环境激素,存在如下转化关系: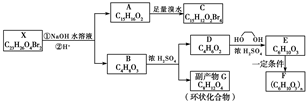
化合物A能与FeCl3溶液发生显色反应,分子中含有两个化学环境完全相同的甲基,其苯环上的一硝基取代物只有两种。1HNMR谱显示化合物G的所有氢原子化学环境相同。F是一种可用于制备隐形眼镜的高聚物。
根据以上信息回答下列问题:
(1)下列叙述正确的是________。
a.化合物A分子中含有联苯结构单元
b.化合物A可以和NaHCO3溶液反应,放出CO2气体
c.X与NaOH溶液反应,理论上1 mol X最多消耗6 mol NaOH
d.化合物D能与Br2发生加成反应
(2)化合物C的结构简式是________,A→C的反应类型是________。
(3)写出同时满足下列条件的D的所有同分异构体的结构简式(不考虑立体异构)________________________________________________。
a.属于酯类 b.能发生银镜反应
(4)写出B→G反应的化学方程式__________________________________________________。
(5)写出E→F反应的化学方程式___________________________________________。
覆盆子酮(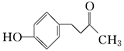 )是一种从植物覆盆子中提取的较为安全的香料。一种以石油化工产品A和丙烯为原料的合成路线如下:
)是一种从植物覆盆子中提取的较为安全的香料。一种以石油化工产品A和丙烯为原料的合成路线如下: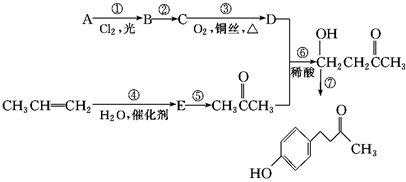
信息提示:
(ⅰ) 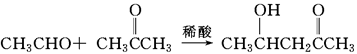
(ⅱ) 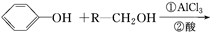

根据上述信息回答:
(1)A的化学名称是________。
(2)C中含有的官能团是________。
(3)与反应⑥反应类型相同的是________(选填反应①~⑦,下同),与反应③反应条件相似的是________。
(4)写出反应⑦的化学方程式_____________________________________。
(5)E的同分异构体有________种(包括E在内),其中在核磁共振氢谱中出现三组峰,且峰面积之比为3∶3∶2的是________________________________(写出结构简式)。
科研、生产中常涉及铁及其化合物
(1)实验室配制FeSO4溶液时,常向溶液中加入的物质有__________________。
(2)高铁酸盐在能源、环保等方面有着广泛的用途,高铁酸钾(K2FeO4)是一种理想的水处理剂,处理水时所起的作用是________________________。
(3)高铁电池是一种新型可充电、能长时间保持稳定放电电压的电池。该电池总反应式为3Zn(OH)2+2Fe(OH)3+4KOH 3Zn+2K2FeO4+8H2O,该电池放电时的负极反应式为________,充电时阳极附近溶液的pH________(填“变大”、“不变”或“变小”)。
3Zn+2K2FeO4+8H2O,该电池放电时的负极反应式为________,充电时阳极附近溶液的pH________(填“变大”、“不变”或“变小”)。
(4)高炉炼铁过程中发生下列反应:
①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ΔH=-24.8 kJ/mol
②3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) ΔH=-47.2 kJ/mol
③3Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) ΔH=+640.4 kJ/mol
请你写出用CO还原FeO固体制得Fe和CO2的热化学方程式:________________。
化学学科中的化学平衡、电离平衡、水解平衡和溶解平衡均符合勒夏特列原理。
请回答下列问题: (1)工业上采取CO和H2为原料合成乙醇,其化学反应方程式为:2CO(g)+4H2(g)
(1)工业上采取CO和H2为原料合成乙醇,其化学反应方程式为:2CO(g)+4H2(g)
CH3CH2OH(g)+H2O(g)。请写出该反应的化学平衡常数表达式K=________。
(2)常温下,浓度均为0.1 mol·L-1的六种溶液的pH如下表:
| 溶质 |
CH3COONa |
NaHCO3 |
Na2CO3 |
NaClO |
NaCN |
Na2SO4 |
| pH |
8.8 |
9.7 |
11.6 |
10.3 |
11.1 |
7.0 |
①上述盐溶液中的阴离子,结合质子能力最强的是________。
②根据表中数据,浓度均为0.01 mol·L-1的下列五种物质的溶液中,酸性最强的是________(填字母);将各溶液分别稀释100倍,pH变化最小的是________(填字母)。
A.HCN B.HClO C.H2SO4 D.CH3COOH E.H2CO3
③把CO2气体通入饱和碳酸钠溶液中,可以观察到的现象为________,原因为________(用离子方程式表示)。
④要增大氯水中HClO的浓度,可向氯水中加入少量的碳酸钠溶液,反应的离子方程式为____________。
(3)某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示。下列说法错误的是_______。
A.加入适量BaCl2(固体)可以使溶液由d点变到c点
B.通过加水稀释可以使溶液由b点变到a点
C.d点无BaSO4沉淀生成
D.a点对应的Ksp等于c点对应的Ksp