已知H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1。以下四个化学反应方程式:
①H2SO4(aq)+2NaOH(aq)===Na2SO4(aq)+2H2O(l);
②H2SO4(aq)+Ba(OH)2(aq)===BaSO4(s)+2H2O(l);
③HCl(aq)+NH3·H2O(aq)===NH4Cl(aq)+H2O(l);
④CH3COOH(aq)+NH3·H2O(aq)===CH3COONH4(aq)+H2O(l),其中反应热为57.3 kJ·mol-1的是( )
| A.①和② | B.③ |
| C.④ | D.以上都不对 |
制印刷电路时常用氯化铁溶液作为“腐蚀液”,发生的反应为2FeCl3+Cu===2FeCl2+CuCl2。向盛有氯化铁溶液的烧杯中同时加入铁粉和铜粉,反应结束后,下列结果不可能出现的是()
| A.烧杯中有铜无铁 | B.烧杯中有铁无铜 |
| C.烧杯中铁、铜都有 | D.烧杯中铁、铜都无 |
下列反应的离子方程式正确的是( )
| A.次氯酸钙溶液中通入过量二氧化碳:Ca2++2ClO-+H2O+CO2===CaCO3↓+2HClO |
| B.硫酸亚铁溶液中加过氧化氢溶液:Fe2++2H2O2+4H+===Fe3++4H2O |
| C.用氨水吸收少量二氧化硫:NH3·H2O+SO2===NH+HSO |
| D.硝酸铁溶液中加过量氨水:Fe3++3NH3·H2O===Fe(OH)3↓+3NH |
某无色溶液中可能含有① 、②
、②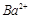 、③
、③ 、④
、④ 、⑤
、⑤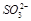 、⑥
、⑥
离子中的若干种,依次进行下列实验,且每步所加试剂均过量,观察到的现象如下。
| 步骤 |
操作 |
现象 |
| (1) |
用pH试纸检验 |
溶液的pH大于7 |
| (2) |
向溶液中加氯水,再加入 振荡,静置 振荡,静置 |
 层呈橙色 层呈橙色 |
| (3) |
向所得水溶液中加入 溶液和稀 溶液和稀 |
有白色沉淀产生 |
| (4) |
过滤,向滤液中加入 溶液和稀 溶液和稀 |
有白色沉淀产生 |
下列结论正确的是( )
A.肯定含有的离子是①④⑤ B.肯定没有的离子是②⑥
C.不能确定的离子是① D.不能确定的离子是③⑤
为测定某镁铝合金样品中铝的含量,进行了下列实验:取一定量合金,加入100 mL 0.3 mol·L-1稀硫酸,合金完全溶解,产生的气体在标准状况下体积为560 mL;再加入0.2 mol·L-1NaOH溶液至沉淀质量恰好不再变化,用去350 mL NaOH溶液。则所取样品中铝的物质的量为( )
| A.0.005 mol | B.0.01 mol | C.0.025 mol | D.0.03 mol |
下表中评价合理的是()
| 选项 |
化学反应及其离子方程式 |
评价 |
| A |
FeO与足量的稀硝酸反应: FeO+2H+=Fe2++H2O |
正确 |
| B |
向硫酸铵溶液中加入氢氧化钡溶液: Ba2++ SO42-=BaSO4↓ |
正确 |
| C |
碳酸氢钠溶液中滴加少量的石灰水: 2HCO3-+Ca2++ 2OH-= CO32- +CaCO3↓+2H2O |
错误,HCO3-、OH-和H2O的系数应均为1,生成物中没有CO32- |
| D |
用食醋除去水瓶中的水垢: CaCO3+2H+=" " Ca2++H2O+CO2↑ |
错误,醋酸是弱酸,不应写成H+形式 |