对于锌—铜—稀H2SO4组成的原电池装置中,当导线中有1 mol 电子通过时,理论上的两极变化是( )
①锌片溶解了32.5 g ②锌片增重32.5 g
③铜片上析出1 g H2 ④铜片上析出1 mol H2
| A.①和③ | B.①和④ | C.②和③ | D.②和④ |
2005年10月12日我国成功发射了第二艘载人航天飞船——“神舟六号”,实现了双人多天太空旅行,这标志着中国人的太空时代又向前迈进了一大步。发射“神六”时用肼 (N2H4)作为火箭发动机的燃料,NO2为氧化剂,反应生成N2和水蒸气。
已知:N2(g)+2O2(g)==2NO2(g);△H=+67.7kJ/mol
N2H4(g)+O2(g)==N2(g)+2H2O(g);△H=-534kJ/tool
下列关于肼和NO2反应的热化学方程式中,正确的是
| A.2N2H4(g)+2NO2(g)==3N2(g)+4H2O(1);AH=-1135.7kJ/mol |
| B.2N2H4(g)+2NO2(g)==3N2(g)+4H2O(g);△H=-1000.3kJ/mol |
| C.N2H4(g)+NO2(g)==3/2N2(g)+2H2O(1);△H=-1135.7kJ/mol |
| D.2N2H4(g)+2NO2(g)==3N2(g)+4H2O(g);△H=-1135.7kJ/mol |
下列说法正确的是
| A.不用其他试剂无法鉴别下列四种溶液:Na2CO3、Al2(SO4)3、NaCl、NaHSO4, |
| B.可以用分液漏斗分离下列三组液态混合物:硝基苯和水、油酸和水、乙酸乙酯和乙醇 |
| C.实验室保存少量液溴和白磷常用水封 |
| D.浓碱溶液沾到了皮肤上要立即用盐酸冲洗 |
为实现“绿色奥运”,下列环保建议中你认为可以采纳的是
①用天然气代替汽油和柴油作为发动机燃料
②开发生产无汞电池
③提倡使用一次性发泡塑料餐具和塑料袋
④分类回收垃圾
⑤开发利用无磷洗涤剂
| A.①③④ | B.②③④⑤ | C.①②④⑤ | D.全部 |
将2 mol A和1 mol B充入某密闭容器中发生反应:2A(g)+B(g) xC(g),达到化学平衡后,C的体积分数为
xC(g),达到化学平衡后,C的体积分数为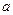 。假设该反应的条件分别和下列各选项的条件相同,下列判断正确的是
。假设该反应的条件分别和下列各选项的条件相同,下列判断正确的是
A.若在恒温恒压下,当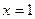 时,按1.5 mol A、l mol C作为起始物质,达到平衡后, C的体积分数仍为
时,按1.5 mol A、l mol C作为起始物质,达到平衡后, C的体积分数仍为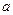
B.若在恒温恒容下,当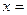 2时,将2mol C作起始物质,达到平衡后,C的体积分数仍为
2时,将2mol C作起始物质,达到平衡后,C的体积分数仍为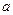
C.若在恒温恒压下,当 时,l mol A、1mol B、6mol C作起始物质,达到平衡后,C的体积分数仍为
时,l mol A、1mol B、6mol C作起始物质,达到平衡后,C的体积分数仍为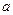
D.若在恒温恒容下,按0.6mol A、0.3mol B、1.4mol C作起始物质,达到平衡后,C的体积分数仍为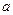 ,则
,则 为2或3
为2或3
据联合国世界卫生组织调查,当今缺铁性贫血是世界上最流行的营养性问题。我国缺铁性贫血发生率达到15%至20%,为此2004年10月9日卫生部启动和推广铁强化酱油计划,以预防缺铁性贫血。所谓铁强化酱油即在普通酱油中加入无铁腥味、极易被人体吸收的添加剂——EDTAFeNa(化学名:乙二胺四乙酸铁钠,通常带三个结晶水,分子式为:C10H12FeN2NaO8·3H2O),其中EDTAFe是一种络合铁,EDTAFe—Na的结构式为: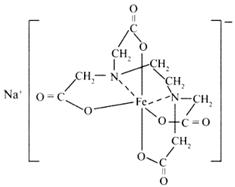
EDTA的结构简式为:(HOOCCH2)2NCH2CH2N(CH2COOH)2,下列说法正确的是
| A.EDTAFeNa中铁为+2价 | B.EDTAFeNa中铁为+3价 |
| C.EDTA属于有机物 | D.人体血液中血红蛋白中铁为+3价 |