CuI是一种白色难溶于水的固体,以石墨作阴极,铜为阳极组成电解池,含有酚酞和淀粉KI的溶液作电解液,电解开始一段时间,阴极区溶液变红,阳极区为无色,电解相当长时间后,阳极区才呈深蓝色,则电解开始阶段的电极反应为( )
| A.阳极:Cu-2e-===Cu2+阴极:Cu2++2e-===Cu |
| B.阳极:2Cu+2I--2e-===2CuI阴极:2H++2e-===H2↑ |
| C.阳极:2I--2e-===I2阴极:2H++2e-===H2↑ |
| D.阳极:4OH--4e-===2H2O+O2↑阴极:4H++4e-===2H2↑ |
某烃具有同分异构体,且各同分异构体的一氯代物的种数相同,该烃的分子式是( )
| A.CH4 | B.C3H8 | C.C4H10 | D.C5H12 |
使1mol乙烯与氯气发生完全加成反应,然后使该加成反应的产物与氯气在光照的条件下发生取代反应全部生成C2H2Cl4,则两个过程中消耗的氯气的总的物质的量是()
| A.3mol | B.4mol | C.5mol | D.6mol |
某直链烷烃分子里有m个氢原子,则含有的碳原子数为()
A.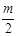 |
B.m-2 | C.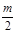 ―1 ―1 |
D.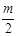 ―2 ―2 |
已知1 mol白磷(s)转化成1 mol红磷,放出18.39 kJ热量,又知:
4P(白磷,s)+ 5O2(g) 2P2O5(s);ΔH1,
2P2O5(s);ΔH1,
4P(红磷,s)+ 5O2(g) 2P2O5(s);ΔH2,则ΔH1和ΔH2的关系正确的是
2P2O5(s);ΔH2,则ΔH1和ΔH2的关系正确的是
| A.ΔH1=ΔH2 | B.ΔH1<ΔH2 | C.ΔH1>ΔH2 | D.无法确定 |
已知反应:① 2C(s)+ O2(g)=2CO(g)ΔH=-221 kJ/mol
② 稀溶液中,H+(aq)+ OH-(aq)=H2O(l)ΔH=-57.3 kJ/mol
下列结论正确的是
| A.碳的燃烧热是110.5 kJ/mol |
| B.反应①的反应热为221 kJ/mol |
| C.稀醋酸与稀NaOH溶液反应生成1 mol水,放出57.3 kJ 热量 |
| D.稀盐酸与稀NaOH溶液反应的中和热为57.3 kJ/mol |